高铁酸钾(K2FeO4)是一种新型多功能水处理剂,其生产利用了离子反应和氧化还原反应原理,具体生产流程如下:
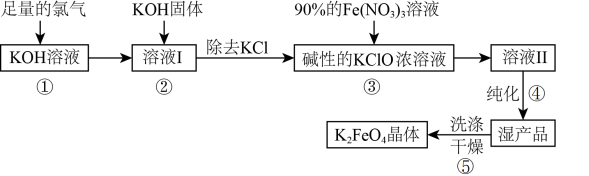
(1)高铁酸钾(K2FeO4)中铁元素的化合价是_______ ,由此推测高铁酸钾具有强_______ 性(填“氧化”或“还原”)。
(2)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,该红褐色胶体的化学式为_______ ,氧化性气体单质的化学式为_______ 。
(3)在溶液Ⅰ中加入KOH固体的目的是_______ (填编号)。
a.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
b.为下一步反应提供碱性的环境
c.与KClO3反应生成KClO
(4)最后产品除得到K2FeO4晶体外,还得到KNO3和KCl两种副产物,请写出第③步的反应离子方程式为:_______ 。

(1)高铁酸钾(K2FeO4)中铁元素的化合价是
(2)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,该红褐色胶体的化学式为
(3)在溶液Ⅰ中加入KOH固体的目的是
a.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
b.为下一步反应提供碱性的环境
c.与KClO3反应生成KClO
(4)最后产品除得到K2FeO4晶体外,还得到KNO3和KCl两种副产物,请写出第③步的反应离子方程式为:
更新时间:2023-10-05 16:20:08
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】I.实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KC1+5Cl2↑+8H2O。请回答以下问题:
(1)将上述化学反应方程式改写为离子方程式___ 。
(2)该反应中氧化剂为___ (填化学式)。起酸性作用的HCl与起还原作用的HCl的质量之比___ 。
(3)已知在碱性溶液中可发生如下反应2R(OH)3+3ClO-+4OH-=2RO +3Cl-+5H2O,则RO
+3Cl-+5H2O,则RO 中R的化合价是
中R的化合价是___ 。
Ⅱ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。
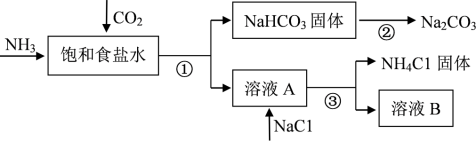
(4)①②③所涉及的操作方法中,包含过滤的是___ (填序号)
(5)根据图,写出①中发生反应的化学方程式___ 。
(1)将上述化学反应方程式改写为离子方程式
(2)该反应中氧化剂为
(3)已知在碱性溶液中可发生如下反应2R(OH)3+3ClO-+4OH-=2RO
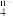 +3Cl-+5H2O,则RO
+3Cl-+5H2O,则RO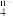 中R的化合价是
中R的化合价是| A.+3 | B.+4 | C.+5 | D.+6 |
Ⅱ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。
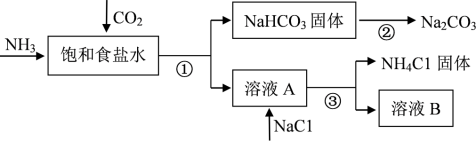
(4)①②③所涉及的操作方法中,包含过滤的是
(5)根据图,写出①中发生反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】完成下列问题。
I.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:
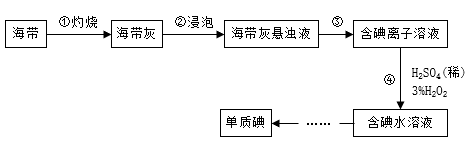
(1)步骤③的实验操作为______ (填实验名称),此过程使用玻璃棒,玻璃棒的作用是____________ 。
(2)步骤④的离子反应方程式为:H2O2+2H++2I-=I2+2H2O。该离子反应中的氧化剂是________ ,还原剂是_______ 。
(3)步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现_______ 色,说明有碘单质产生。
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,I-被氧气氧化成碘单质(I2),同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的化学方程式:_______ 。
现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:
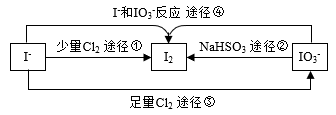
(5)四个途径中属于氧化还原反应的是______ (填序号)。
(6)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:Cl2+KIO3+2KOH=2KCl+KIO4+H2O,写出该反应的离子方程式:________ 。
(7)比较I2、 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:_________ 。
I.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:

(1)步骤③的实验操作为
(2)步骤④的离子反应方程式为:H2O2+2H++2I-=I2+2H2O。该离子反应中的氧化剂是
(3)步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,I-被氧气氧化成碘单质(I2),同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的化学方程式:
现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:

(5)四个途径中属于氧化还原反应的是
(6)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:Cl2+KIO3+2KOH=2KCl+KIO4+H2O,写出该反应的离子方程式:
(7)比较I2、
 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】二氧化氯( )具有强氧化性,是一种高效消毒剂。
)具有强氧化性,是一种高效消毒剂。 常温下为黄绿色气体,熔点-59°沸点11°C,极易溶于水且不与水反应。高浓度的
常温下为黄绿色气体,熔点-59°沸点11°C,极易溶于水且不与水反应。高浓度的 受热时易爆炸。实验室可用干燥的氯气与亚氯酸钠(
受热时易爆炸。实验室可用干燥的氯气与亚氯酸钠( )固体反应来制备
)固体反应来制备 ,反应为:
,反应为: ,装置如图所示。
,装置如图所示。
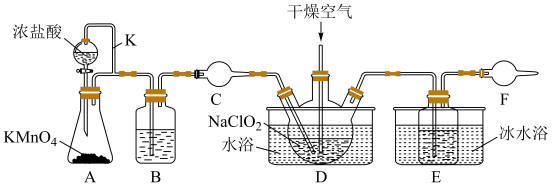
(1)A中盛放 的装置名称为
的装置名称为______ ;导气管K的作用是______ 。
(2)A中发生反应方程式: ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为______ 。
(3)B中试剂的作用是______ 。
(4)C中可选用的试剂是______ 。
(5)实验时需要向D中通入一定量的干燥空气,目的是______ 。
(6)若将E中收集到的 加入
加入 和
和 的混合溶液中,可生成
的混合溶液中,可生成 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
(7)城市饮用水处理,新技术用 替代
替代 ,其中氯元素都被还原为
,其中氯元素都被还原为 ,如果以单位质量的氧化剂,得到的电子数来表示消毒效率,那么消毒杀菌剂
,如果以单位质量的氧化剂,得到的电子数来表示消毒效率,那么消毒杀菌剂 的消毒效率是
的消毒效率是 的
的______ 倍(结果保留两位小数)。
 )具有强氧化性,是一种高效消毒剂。
)具有强氧化性,是一种高效消毒剂。 常温下为黄绿色气体,熔点-59°沸点11°C,极易溶于水且不与水反应。高浓度的
常温下为黄绿色气体,熔点-59°沸点11°C,极易溶于水且不与水反应。高浓度的 受热时易爆炸。实验室可用干燥的氯气与亚氯酸钠(
受热时易爆炸。实验室可用干燥的氯气与亚氯酸钠( )固体反应来制备
)固体反应来制备 ,反应为:
,反应为: ,装置如图所示。
,装置如图所示。
(1)A中盛放
 的装置名称为
的装置名称为(2)A中发生反应方程式:
 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(3)B中试剂的作用是
(4)C中可选用的试剂是
(5)实验时需要向D中通入一定量的干燥空气,目的是
(6)若将E中收集到的
 加入
加入 和
和 的混合溶液中,可生成
的混合溶液中,可生成 ,该反应的离子方程式为
,该反应的离子方程式为(7)城市饮用水处理,新技术用
 替代
替代 ,其中氯元素都被还原为
,其中氯元素都被还原为 ,如果以单位质量的氧化剂,得到的电子数来表示消毒效率,那么消毒杀菌剂
,如果以单位质量的氧化剂,得到的电子数来表示消毒效率,那么消毒杀菌剂 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】含氮的化合物在化学反应中变化复杂。
Ⅰ.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①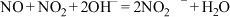 ;
;
②气体液化的温度: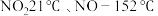 。
。___________ 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:___________ 。
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%硫酸的仪器名称是___________ ;
②实验确认有NO的现象是___________ 。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是___________ 。
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇。
b.在230℃以上时,同时有弱光: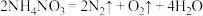
c.在400℃以上时,剧烈分解发生爆炸:
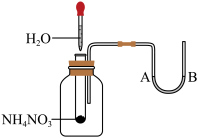
(5)如图将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因___________ 。___________ ,___________ (填“能”或“不能”)用硝酸铵代替氯化铵。
(7)完成离子反应Ⅳ:________ 。
 。
。
Ⅰ.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①
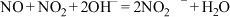 ;
;②气体液化的温度:
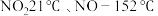 。
。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%硫酸的仪器名称是
②实验确认有NO的现象是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
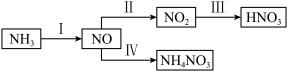
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇。
b.在230℃以上时,同时有弱光:
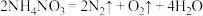
c.在400℃以上时,剧烈分解发生爆炸:

(5)如图将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因
(7)完成离子反应Ⅳ:
 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4,即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如下:

(1)反应器中反应的化学方程式为_______ 。
(2)电解槽中总反应的化学方程式为_______ 。
(3)在传统工艺中得到K2MnO4后,向其溶液中通入适量CO2反应生成黑色固体、KMnO4等,反应的离子方程式为_______ 。与该传统工艺相比,电解法的优势是_______ 。
(4)用高锰酸钾测定草酸结晶水合物H2C2O4·2H2O的纯度:称草酸晶体样品0.500g溶于水配制成100mL溶液,取出20.00 mL用0.0200mol/L的酸性KMnO4溶液滴定(杂质不反应),恰好完全反应时消耗KMnO4溶液14.00mL,则该草酸晶体的纯度为多少,给出计算过程_______ 。

(1)反应器中反应的化学方程式为
(2)电解槽中总反应的化学方程式为
(3)在传统工艺中得到K2MnO4后,向其溶液中通入适量CO2反应生成黑色固体、KMnO4等,反应的离子方程式为
(4)用高锰酸钾测定草酸结晶水合物H2C2O4·2H2O的纯度:称草酸晶体样品0.500g溶于水配制成100mL溶液,取出20.00 mL用0.0200mol/L的酸性KMnO4溶液滴定(杂质不反应),恰好完全反应时消耗KMnO4溶液14.00mL,则该草酸晶体的纯度为多少,给出计算过程
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3

已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________ ,滤渣的主要成分为________________________ ;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________ ;反应完全后,除去多余H2O2的简便方法是______________________ ;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________ (用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________ ;

已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】一种以电解锰阳极泥废渣(主要成分为MnO2、Pb2+、Cu2+、Mg2+、K+及Cl—等)和木屑(主要成分为纤维素)为原料制取MnSO4的工艺流程如下:
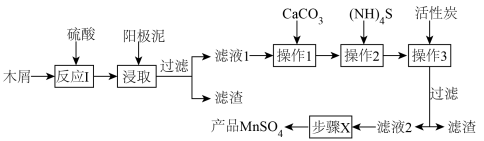
(1)“反应1”的产物为C6H12O6,硫酸作______ (填“氧化剂”“还原剂”或“催化剂”),
(2)为提高锰的浸取率,采取的措施合理的是_______ (填标号)。
a.缩短浸取和搅拌的时间b.适当升高浸取的温度c.加入更多的阳极泥
(3)“操作1”的目的是_______ ,“操作3”的目的是___________ 。
(4)”滤液2”制取MnSO4晶体还需进行的操作有浓缩结晶、过滤、_____ 、_____ 。

(1)“反应1”的产物为C6H12O6,硫酸作
(2)为提高锰的浸取率,采取的措施合理的是
a.缩短浸取和搅拌的时间b.适当升高浸取的温度c.加入更多的阳极泥
(3)“操作1”的目的是
(4)”滤液2”制取MnSO4晶体还需进行的操作有浓缩结晶、过滤、
您最近一年使用:0次
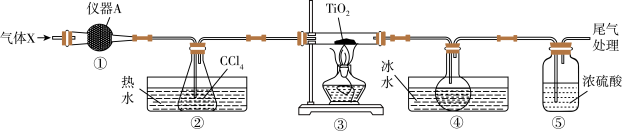
【推荐2】TiCl4是制备Ti的重要中间产物,实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装置省略)。
已知:有关物质的性质如表:
请回答下列问题:
(1)仪器A的名称是_______ 。装置①中气体X和仪器A中药品的组合为_______ 。
a.CO2、碱石灰 b.N2、碱石灰 c.N2、浓硫酸 d.O2、碱石灰
(2)装置②中热水的作用是_______ ;装置⑤中浓硫酸的作用是_______ 。
(3)TiCl4遇潮反应的化学方程式为_______ 。
(4)装置④烧瓶中的物质为TiCl4和_______ ,分离出TiCl4的方法是_______ (填操作名称)。
(5)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,同时生成CO和CO2混合气体,请设计实验验证产物中CO气体:_______ 。

已知:有关物质的性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
| TiO2 | 1830 | 3200 | 无 |
(1)仪器A的名称是
a.CO2、碱石灰 b.N2、碱石灰 c.N2、浓硫酸 d.O2、碱石灰
(2)装置②中热水的作用是
(3)TiCl4遇潮反应的化学方程式为
(4)装置④烧瓶中的物质为TiCl4和
(5)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,同时生成CO和CO2混合气体,请设计实验验证产物中CO气体:
您最近一年使用:0次
【推荐3】某工厂的工业废水中含有大量的 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:

(1)操作Ⅰ和操作Ⅱ的方法是_______ 。
(2)步骤①加入的铁粉应_______ (选填“过量”或“少量”),写出该步骤中发生的所有氧化还原反应的离子方程式_______ 。
(3)固体A的成分是_______ (填名称)。
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为_______ ,该物质在该反应中作_______ 剂(选填“氧化”或“还原”)。
(5)取 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式_______ 。
(6)如何检验所得 中不含有
中不含有
_______ 。
 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:
(1)操作Ⅰ和操作Ⅱ的方法是
(2)步骤①加入的铁粉应
(3)固体A的成分是
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为
(5)取
 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式(6)如何检验所得
 中不含有
中不含有
您最近一年使用:0次



