25℃时,某小组同学分别用如下方法测定CH3COOH的电离常数(Ka)。
【方法一】实验步骤:
i.取amL稀CH3COOH溶液于锥形瓶中,再加入……
ii.用c1mol•L-1NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V1mL。
iii.另取一份该稀CH3COOH溶液于烧杯中,用pH计测得其pH为x。
(1)CH3COOH电离方程式为______ 。
(2)补全i中试剂及用量______ 。
(3)该稀CH3COOH溶液的浓度c=______ mol•L-1(用代数式表示)。
数据处理:醋酸的电离平衡常数Ka=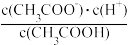 ≈
≈ 。代入相关数据,即可得Ka。
。代入相关数据,即可得Ka。
误差分析:
(4)若i中锥形瓶提前用该稀CH3COOH溶液进行了润洗,会使测得的Ka______ 。(填“偏大”、“偏小”、“无影响”)
【方法二】实验原理:
由CH3COOH的电离平衡常数表达式可知,当c(CH3COO-)=c(CH3COOH)时,Ka=c(H+)。
实验步骤:①取25mL某CH3COOH溶液,用NaOH溶液滴定至终点。
②继续向①中加入一定量的该CH3COOH溶液。
③用pH计测定②中混合溶液的pH为y。
(5)为保证c(CH3COO-)≈c(CH3COOH),步骤②中加入的CH3COOH溶液应为______ 。(填序号)
数据处理:
(6)Ka=______ (用代数式表示)。
迁移应用:
(7)已知亚磷酸(H3PO3)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是______ (填字母序号)。
A.H3PO3的Ka1=10-1.43
B.NaH2PO3溶液显碱性
C.向H3PO3溶液中逐滴加入NaOH溶液至pH=6.54,发生反应:3OH-+2H3PO3=H2PO +HPO
+HPO +3H2O
+3H2O
【方法一】实验步骤:
i.取amL稀CH3COOH溶液于锥形瓶中,再加入……
ii.用c1mol•L-1NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V1mL。
iii.另取一份该稀CH3COOH溶液于烧杯中,用pH计测得其pH为x。
(1)CH3COOH电离方程式为
(2)补全i中试剂及用量
(3)该稀CH3COOH溶液的浓度c=
数据处理:醋酸的电离平衡常数Ka=
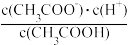 ≈
≈ 。代入相关数据,即可得Ka。
。代入相关数据,即可得Ka。误差分析:
(4)若i中锥形瓶提前用该稀CH3COOH溶液进行了润洗,会使测得的Ka
【方法二】实验原理:
由CH3COOH的电离平衡常数表达式可知,当c(CH3COO-)=c(CH3COOH)时,Ka=c(H+)。
实验步骤:①取25mL某CH3COOH溶液,用NaOH溶液滴定至终点。
②继续向①中加入一定量的该CH3COOH溶液。
③用pH计测定②中混合溶液的pH为y。
(5)为保证c(CH3COO-)≈c(CH3COOH),步骤②中加入的CH3COOH溶液应为
| A.25mL | B.50mL | C.75mL | D.用量与①中使用的NaOH溶液浓度有关 |
数据处理:
(6)Ka=
迁移应用:
(7)已知亚磷酸(H3PO3)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是
A.H3PO3的Ka1=10-1.43
B.NaH2PO3溶液显碱性
C.向H3PO3溶液中逐滴加入NaOH溶液至pH=6.54,发生反应:3OH-+2H3PO3=H2PO
 +HPO
+HPO +3H2O
+3H2O
更新时间:2023-09-23 15:37:25
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】近期科学家首次发现像大脑样的学习材料—— VO2,某小组以接触法制硫酸的废催化剂(主要成分是V2O5,含少量Fe2O3、CuO、Al2O3等杂质)为原料制备VO2的流程如下:

已知:①NH4VO3难溶于水,(VO2)2SO4易溶于水;
② +2H+
+2H+ 
 + H2O;
+ H2O;
③几种金属离子以氢氧化物沉淀时的pH如下表。
请回答下列问题:
(1)“碱浸”中提高反应速率的可行措施有___________ (答两条)。
(2)“煅烧1”发生主要反应的化学方程式为___________ 。
(3)理论上,为实现Cu2+完全沉淀,应调节pH=6.0,工业生产中,常调节pH=8.0,其目的是___________ (用化学用语和必要的文字说明)。
(4)滤渣2的主要成分是Cu(OH)2和___________ (填化学式)。“煅烧2”需要在流动空气中煅烧的原因可能是___________ 。
(5)将2.075g VO2产品溶于强碱溶液,加热煮沸,调节pH为8.5,将溶液稀释至250.00mL溶液。取25.00mL稀释后的溶液于锥形瓶中,加入硫酸酸化的KI溶液(过量) ,溶液中的还原产物为V3+,滴加指示剂,用0. 10 mol∙L−1Na2S2O3溶液滴定,重复三次,测得数据如下表所示:
该产品的纯度为___________ %。若滴定过程中,振荡时间太长,则测得的结果___________ (填“偏高”“偏 低”或“无影响”)。(已知:2Na2S2O3 +I2 =Na2S4O6 + 2NaI)

已知:①NH4VO3难溶于水,(VO2)2SO4易溶于水;
②
 +2H+
+2H+ 
 + H2O;
+ H2O;③几种金属离子以氢氧化物沉淀时的pH如下表。
| 金属氢氧化物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 2.7 | 4.0 | 4.6 |
| 完全沉淀的pH | 3.7 | 5.2 | 6.0 |
(1)“碱浸”中提高反应速率的可行措施有
(2)“煅烧1”发生主要反应的化学方程式为
(3)理论上,为实现Cu2+完全沉淀,应调节pH=6.0,工业生产中,常调节pH=8.0,其目的是
(4)滤渣2的主要成分是Cu(OH)2和
(5)将2.075g VO2产品溶于强碱溶液,加热煮沸,调节pH为8.5,将溶液稀释至250.00mL溶液。取25.00mL稀释后的溶液于锥形瓶中,加入硫酸酸化的KI溶液(过量) ,溶液中的还原产物为V3+,滴加指示剂,用0. 10 mol∙L−1Na2S2O3溶液滴定,重复三次,测得数据如下表所示:
| 序号 | 起始读数 | 终点读数 |
| ① | 0.10 | 20.55 |
| ② | 0. 02 | 20.12 |
| ③ | 0.03 | 19. 93 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】 (一水硫酸四氨合铜)是一种深蓝色晶体,易溶于水、不溶于乙醇,常作杀虫剂、媒染剂。某小组以纯铜为主要原料制备
(一水硫酸四氨合铜)是一种深蓝色晶体,易溶于水、不溶于乙醇,常作杀虫剂、媒染剂。某小组以纯铜为主要原料制备 的流程如下:
的流程如下:
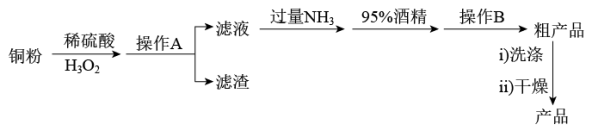
请回答下列问题:
(1)铜粉与含 的稀硫酸反应的离子方程式为
的稀硫酸反应的离子方程式为___________ 。从绿色化学角度考虑,在加热条件下,下列物质可以替代双氧水的是___________ (填字母)。
a.氯气 b.氧气 c.硝酸钾 d.氧化铁
(2)实验室里完成操作A,宜选择下列装置___________(填字母)。
(3)流程中加入95%酒精的目的是___________ 。观察到的主要现象是___________ 。
(4)利用如图装置完成操作B,相对操作A,操作B的突出优点是___________ 。

(5)“干燥”温度不宜过高,其原因是___________ 。
(6)用“碘量法”测定产品纯度。
准确称取wg产品,配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,加入过量KI溶液,用 标准溶液滴定,消耗标准溶液体积为VmL,已知:
标准溶液滴定,消耗标准溶液体积为VmL,已知: 的摩尔质量为
的摩尔质量为 。有关反应有:
。有关反应有: ,
, ,
, 。
。
①选择指示剂是___________ 。
②该产品纯度为___________ 。
 (一水硫酸四氨合铜)是一种深蓝色晶体,易溶于水、不溶于乙醇,常作杀虫剂、媒染剂。某小组以纯铜为主要原料制备
(一水硫酸四氨合铜)是一种深蓝色晶体,易溶于水、不溶于乙醇,常作杀虫剂、媒染剂。某小组以纯铜为主要原料制备 的流程如下:
的流程如下:
请回答下列问题:
(1)铜粉与含
 的稀硫酸反应的离子方程式为
的稀硫酸反应的离子方程式为a.氯气 b.氧气 c.硝酸钾 d.氧化铁
(2)实验室里完成操作A,宜选择下列装置___________(填字母)。
A.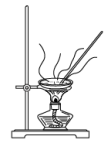 | B.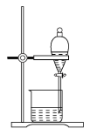 | C.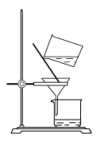 | D.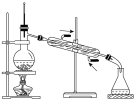 |
(4)利用如图装置完成操作B,相对操作A,操作B的突出优点是

(5)“干燥”温度不宜过高,其原因是
(6)用“碘量法”测定产品纯度。
准确称取wg产品,配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,加入过量KI溶液,用
 标准溶液滴定,消耗标准溶液体积为VmL,已知:
标准溶液滴定,消耗标准溶液体积为VmL,已知: 的摩尔质量为
的摩尔质量为 。有关反应有:
。有关反应有: ,
, ,
, 。
。①选择指示剂是
②该产品纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】回答酸碱滴定实验中的下列问题:
(1)下列有关滴定操作的顺序正确的是_______
①检查滴定管是否漏水②用蒸馏水洗涤玻璃仪器③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管④滴定操作⑤装标准溶液和待测液并调整液面(记录初始读数)⑥取一定体积的待测液于锥形瓶中,并滴加指示剂
(2)下图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积是__________ mL。
(3)下图Ⅱ表示25.00 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)__________。

(4)上图Ⅲ为用一标准浓度NaOH溶液滴定20.00 mL未知浓度的盐酸时的滴定曲线。则两种溶液的物质的量浓度分别是:c(HCl)=________ ,c(NaOH)=_______________ 。
(5)滴定过程中,下列操作中会使测定结果偏低的有____________
(1)下列有关滴定操作的顺序正确的是_______
①检查滴定管是否漏水②用蒸馏水洗涤玻璃仪器③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管④滴定操作⑤装标准溶液和待测液并调整液面(记录初始读数)⑥取一定体积的待测液于锥形瓶中,并滴加指示剂
| A.①③②④⑤⑥ | B.①②③⑤⑥④ | C.②③①④⑤⑥ | D.④⑤①②③⑥ |
(3)下图Ⅱ表示25.00 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)__________。
| A.a mL | B.(25-a) mL | C.大于a mL | D.大于(25-a)mL |

(4)上图Ⅲ为用一标准浓度NaOH溶液滴定20.00 mL未知浓度的盐酸时的滴定曲线。则两种溶液的物质的量浓度分别是:c(HCl)=
(5)滴定过程中,下列操作中会使测定结果偏低的有____________
| A.酸式滴定管未润洗 | B.锥形瓶内有少量水 |
| C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失 | D.滴定前仰视滴定管读数,滴定后平视刻度读数 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】雌黄(As2S3)和雄黄(As4S4)是一对共生矿物,有“矿物鸳鸯”的说法。我国古代书画家曾用其作绘画颜料,因有抗病毒疗效,故在中医治疗中也有非常广泛的用途。
(1)基态砷原子价电子排布式为_______ 。
(2)同主族元素N、P、As,第一电离能最大的为_______ ;同周期元素Si、P、S,电负性最小的为_______ 。
(3)雌黄可以转化为用于治疗白血病的亚砷酸(H3AsO3),亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示:

①人体血液的pH为7.35~7.45,用药后人体所含砷元素的主要微粒是_______ 。
②将KOH溶液滴入H3AsO3溶液中,当pH从11调至12时,反应的离子方程式是_______ 。
③Ka1(H3AsO3)的数量级是_______ 。
(4)工业含砷(III)废水常用铁盐絮凝剂处理后排放。其原理是:铁盐絮凝剂在溶液中产生Fe(OH)3胶体,表面积大吸附性强,且Fe(OH)3胶粒表面带有正电荷。通过实验测得不同pH铁盐絮凝剂对含砷(III)化合物的去除率如图所示:

①铁盐对含砷(III)化合物的去除最佳条件是_______ 。
②铁盐絮凝剂的组成为 ,其在溶液中产生Fe(OH)3胶体的化学反应方程式是
,其在溶液中产生Fe(OH)3胶体的化学反应方程式是_______ 。
③其他条件一定,溶液pH=9时,铁盐絮凝剂对含砷(III)化合物的去除效果比pH=5时效果明显要好,原因是_______ 。
(1)基态砷原子价电子排布式为
(2)同主族元素N、P、As,第一电离能最大的为
(3)雌黄可以转化为用于治疗白血病的亚砷酸(H3AsO3),亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示:

①人体血液的pH为7.35~7.45,用药后人体所含砷元素的主要微粒是
②将KOH溶液滴入H3AsO3溶液中,当pH从11调至12时,反应的离子方程式是
③Ka1(H3AsO3)的数量级是
(4)工业含砷(III)废水常用铁盐絮凝剂处理后排放。其原理是:铁盐絮凝剂在溶液中产生Fe(OH)3胶体,表面积大吸附性强,且Fe(OH)3胶粒表面带有正电荷。通过实验测得不同pH铁盐絮凝剂对含砷(III)化合物的去除率如图所示:

①铁盐对含砷(III)化合物的去除最佳条件是
②铁盐絮凝剂的组成为
 ,其在溶液中产生Fe(OH)3胶体的化学反应方程式是
,其在溶液中产生Fe(OH)3胶体的化学反应方程式是③其他条件一定,溶液pH=9时,铁盐絮凝剂对含砷(III)化合物的去除效果比pH=5时效果明显要好,原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.回答下列问题
(1)写出甲基的电子式___________ ;写出纯碱的化学式___________ 。
(2)过氧化钠可用作呼吸面具中的供氧剂,写出Na2O2与CO2反应的化学方程式___________ 。
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体HCl___________ 。
Ⅱ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
(4)HClO、H2CO3、H2SO3三种酸酸性由强到弱的顺序是___________ ;
(5)下列离子在溶液中不能大量共存的是___________
(1)写出甲基的电子式
(2)过氧化钠可用作呼吸面具中的供氧剂,写出Na2O2与CO2反应的化学方程式
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体HCl
Ⅱ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
| 物质 | 平衡常数 |
| HClO | Ka=4.7×10-8 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(5)下列离子在溶液中不能大量共存的是___________
A.SO 、HCO 、HCO | B.HSO 、CO 、CO | C.SO 、CO 、CO | D.ClO-、HCO |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)草酸是一种二元弱酸,在菠菜、苋菜等植物中含量较高,其水溶液与酸性KMnO4溶液反应的离子方程式为:2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,常温下草酸(H2C2O4)中H2C2O4、HC2O
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,常温下草酸(H2C2O4)中H2C2O4、HC2O 、C2O
、C2O 粒子分布分数与pH的关系如图所示:
粒子分布分数与pH的关系如图所示:

①NaHC2O4溶液中c(H2C2O4)_______ c(C2O )(填“大分布分数于”“等于”或“小于”)。
)(填“大分布分数于”“等于”或“小于”)。
②计算a点的pH=_______ 。
③pH=4.19时,c(Na+)_______ 3c(C2O )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
(2)碳酸钠的水溶液呈碱性的原因是_______ (用相关离子方程式表示)。
(3)为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
①x=_______ 。
②下列操作中,可能使所测x数值偏低的是_______ (填编号)。
A.滴定管未用标准KMnO4溶液润洗就直接注入标准KMnO4溶液
B.滴定前盛放草酸稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振摇时有液滴溅出
D.读取KMnO4溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.装KMnO4溶液滴定管在滴定前有气泡,滴定后气泡消失
(4)将0.04mol的BaSO4完全溶于1L的碳酸钠溶液,其c(Na2CO3)至少为_______ mol·L-1。(结果精确到0.01)(Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9)
(1)草酸是一种二元弱酸,在菠菜、苋菜等植物中含量较高,其水溶液与酸性KMnO4溶液反应的离子方程式为:2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,常温下草酸(H2C2O4)中H2C2O4、HC2O
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,常温下草酸(H2C2O4)中H2C2O4、HC2O 、C2O
、C2O 粒子分布分数与pH的关系如图所示:
粒子分布分数与pH的关系如图所示:
①NaHC2O4溶液中c(H2C2O4)
 )(填“大分布分数于”“等于”或“小于”)。
)(填“大分布分数于”“等于”或“小于”)。②计算a点的pH=
③pH=4.19时,c(Na+)
 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。(2)碳酸钠的水溶液呈碱性的原因是
(3)为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
| 实验序号 | V(KMnO4溶液) | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 0.10 | 10.00 |
| 2 | 1.10 | 11.10 |
| 3 | 1.50 | 13.50 |
| 4 | 0.70 | 10.80 |
②下列操作中,可能使所测x数值偏低的是
A.滴定管未用标准KMnO4溶液润洗就直接注入标准KMnO4溶液
B.滴定前盛放草酸稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振摇时有液滴溅出
D.读取KMnO4溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.装KMnO4溶液滴定管在滴定前有气泡,滴定后气泡消失
(4)将0.04mol的BaSO4完全溶于1L的碳酸钠溶液,其c(Na2CO3)至少为
您最近一年使用:0次
【推荐1】目前“低碳减排”备受关注, 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。
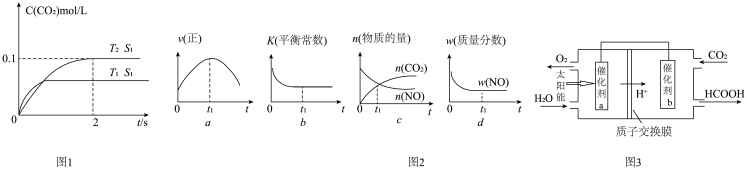
(1)汽车尾气净化的主要原理为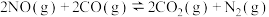 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度
随温度 、催化剂表面积
、催化剂表面积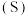 和时间
和时间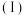 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:
①该反应的
______  填“
填“ ”或“
”或“ ”
” 。
。
②在 温度下,
温度下, 内的平均反应速率
内的平均反应速率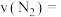
______  。
。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积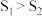 ,在答题卡相应图中画出
,在答题卡相应图中画出 在
在 、
、 条件下达到平衡过程中的变化曲线
条件下达到平衡过程中的变化曲线_____ 。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到 时刻达到平衡状态的是
时刻达到平衡状态的是______  填代号
填代号 。
。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
例如: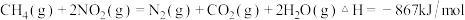
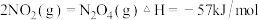
写出 催化还原
催化还原 生成
生成 、
、 和
和 的热化学方程式:
的热化学方程式:______ 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图。催化剂b表面发生的电极反应为
的原理示意图。催化剂b表面发生的电极反应为______
③常温下 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数
______ 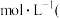 填写最终计算结果
填写最终计算结果 。
。
 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。
(1)汽车尾气净化的主要原理为
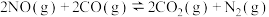 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度
随温度 、催化剂表面积
、催化剂表面积 和时间
和时间 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:①该反应的

 填“
填“ ”或“
”或“ ”
” 。
。②在
 温度下,
温度下, 内的平均反应速率
内的平均反应速率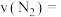
 。
。③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积
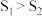 ,在答题卡相应图中画出
,在答题卡相应图中画出 在
在 、
、 条件下达到平衡过程中的变化曲线
条件下达到平衡过程中的变化曲线④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到
 时刻达到平衡状态的是
时刻达到平衡状态的是 填代号
填代号 。
。(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用
 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。例如:
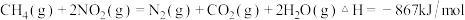
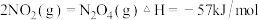
写出
 催化还原
催化还原 生成
生成 、
、 和
和 的热化学方程式:
的热化学方程式:②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以
 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图。催化剂b表面发生的电极反应为
的原理示意图。催化剂b表面发生的电极反应为③常温下
 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数
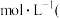 填写最终计算结果
填写最终计算结果 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】【化学-物质结构与性质】许多过渡元素(如锰、钒、铬、铁、铜等)的化合物对化学反应具有良好的催化性。回答下列问题:
(1)基态铬原子的价层电子排布式为_________ ;Mn2+的稳定性强于Mn3+,其原因是_______ 。
(2)已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2<<K1的原因是_________ 。已知Cr2(SO4)3的熔点为100℃、沸点为330℃,则Cr2(SO4)3晶体中微粒间的相互作用力是__________ 。
(3)SO2与氧气在V2O5催化作用下反应可转化为SO3,则转化过程中_____ (填字母)没有发生变化。
a.中心原子轨道杂化类型 b.键角 c.分子的极性
(4)+5价钒能形成多种含氧酸根盐,其中某种钠盐的酸根离子是一种具有无限链状结构的离子(见下图),则该酸根离子的化学式为__________ 。

(5)CuSO4溶液中Cu2+是以[Cu(H2O)4]2+形式存在的,向CuSO4溶液中加入过量氨水后会得到[Cu(NH3)4]2+,则上述两种配离子中稳定性较强的是_________ ,N、O、S、Cu 四种元素的第一电离能由大到小的顺序为__________ 。
(1)基态铬原子的价层电子排布式为
(2)已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2<<K1的原因是
(3)SO2与氧气在V2O5催化作用下反应可转化为SO3,则转化过程中
a.中心原子轨道杂化类型 b.键角 c.分子的极性
(4)+5价钒能形成多种含氧酸根盐,其中某种钠盐的酸根离子是一种具有无限链状结构的离子(见下图),则该酸根离子的化学式为

(5)CuSO4溶液中Cu2+是以[Cu(H2O)4]2+形式存在的,向CuSO4溶液中加入过量氨水后会得到[Cu(NH3)4]2+,则上述两种配离子中稳定性较强的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1 NaOH溶液滴定10mL0.1
NaOH溶液滴定10mL0.1
 溶液的滴定曲线如下图所示。
溶液的滴定曲线如下图所示。

①a点溶液的pH___________ 1(填“>”、“<”或“=”)。
②b点溶液中的溶质为___________ (填化学式)。。
③c点溶液中,
___________  。
。
④a、b、c三点中,水的电离程度最大的点为___________ 。
(2)已知:25℃时 、
、 和HCl0的电离平衡常数:
和HCl0的电离平衡常数:
①25℃时,浓度均为0.1 的
的 溶液、
溶液、 溶液、NaClO溶液的碱性由大到小的排序是
溶液、NaClO溶液的碱性由大到小的排序是___________ 。
②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1 ,达到电离平衡时溶液中
,达到电离平衡时溶液中
___________  。
。
③下列化学反应可能发生的是___________ 。
A.
B.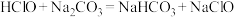
C.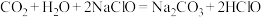
D.
(1)常温下,用0.1
 NaOH溶液滴定10mL0.1
NaOH溶液滴定10mL0.1
 溶液的滴定曲线如下图所示。
溶液的滴定曲线如下图所示。
①a点溶液的pH
②b点溶液中的溶质为
③c点溶液中,

 。
。④a、b、c三点中,水的电离程度最大的点为
(2)已知:25℃时
 、
、 和HCl0的电离平衡常数:
和HCl0的电离平衡常数:| 化学式 |  |  | HClO |
电离平衡常数( ) ) |  | 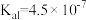 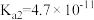 |  |
①25℃时,浓度均为0.1
 的
的 溶液、
溶液、 溶液、NaClO溶液的碱性由大到小的排序是
溶液、NaClO溶液的碱性由大到小的排序是②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1
 ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。
。③下列化学反应可能发生的是
A.

B.
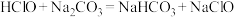
C.
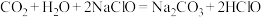
D.

您最近一年使用:0次



