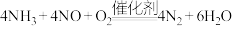下列关于有效碰撞理论的说法一定正确的是
| A.活化分子之间发生的碰撞一定是有效碰撞 |
| B.增大压强,反应的有效碰撞次数增多,反应速率加快 |
| C.升高温度,反应的活化能降低,反应速率加快 |
| D.使用催化剂,单位体积内活化分子数增多,反应速率加快 |
更新时间:2023-11-10 16:14:02
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A+B→X的活化能,下列说法正确的是
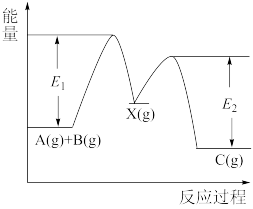

| A.△H1=△H-△H2 >0 | B.X是反应A(g)+B(g)→C(g)的催化剂 |
| C.E2是反应②的活化能 | D.△H = E1-E2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列说法正确的是
| A.活化分子间的碰撞一定能发生化学反应 |
| B.普通分子间的碰撞有时也能发生化学反应 |
| C.增大浓度,活化分子百分数增大 |
| D.化学反应的实质是活化分子有合适取向时的有效碰撞 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】下列实验方案不能达到相应目的的是
A.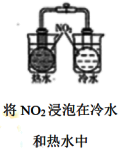 研究温度对化学平衡的影响 研究温度对化学平衡的影响 |
B.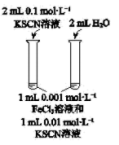 研究浓度对化学平衡的影响 研究浓度对化学平衡的影响 |
C. 研究浓度对化学反应速率的影响 研究浓度对化学反应速率的影响 |
D. 比较碳酸、醋酸和硼酸的酸性强弱 比较碳酸、醋酸和硼酸的酸性强弱 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】一定温度下,在体积为2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g)。反应过程中的部分数据如表所示:
2NH3(g)。反应过程中的部分数据如表所示:
下列说法不正确 的是
 2NH3(g)。反应过程中的部分数据如表所示:
2NH3(g)。反应过程中的部分数据如表所示:| n/(mol) t/min | n(N2) | n(H2) | n(NH3) |
| 0 | 1.0 | 3.0 | 0 |
| 2 | 0.875 | ||
| 4 | 0.4 | ||
| 8 | 0.8 |
| A.升高温度,正反应速率和逆反应速率都增大 |
| B.0~2min内,用NH3表示的平均反应速率为0.0625mol•L-1•min-1 |
| C.该反应达到化学反应限度时,N2的转化率为20% |
| D.容器内气体的密度保持不变,说明该反应已达到化学平衡状态 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列事实或做法与化学反应速率无关的是
| A.制造蜂窝煤时加入生石灰 | B.家用铁锅、铁铲等餐具保持干燥 |
| C.常用冰箱保存食物 | D.氨的合成加入铁粉 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】汽车尾气无害化处理的反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH<0。下列说法不正确的是
| A.升高温度,活化分子百分数增大,正、逆反应速率都加快 |
| B.使用催化剂,活化分子百分数增大,正、逆反应速率都加快 |
| C.使用催化剂可以降低反应的活化能 |
| D.升高温度,上述反应的平衡常数会增大 |
您最近一年使用:0次

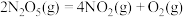 提出下列三步机理(
提出下列三步机理(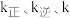 为速率常数):
为速率常数):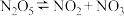
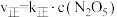
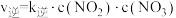 ;
;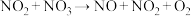
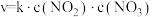 ;
;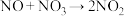

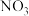 的碰撞仅部分发生反应
的碰撞仅部分发生反应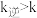
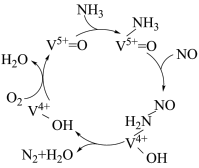

 在整个反应中起到催化作用
在整个反应中起到催化作用