已知:NO和 转化为
转化为 的反应机理如下:
的反应机理如下:
① (快)
(快)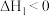 平衡常数
平衡常数
②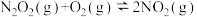 (慢)
(慢)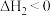 平衡常数
平衡常数
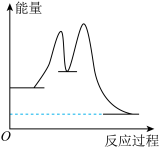
下列说法正确的是
 转化为
转化为 的反应机理如下:
的反应机理如下:①
 (快)
(快)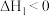 平衡常数
平衡常数
②
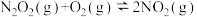 (慢)
(慢)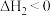 平衡常数
平衡常数
下列说法正确的是

A. 的 的 |
B.反应②的速率大小决定 的反应速率 的反应速率 |
| C.反应过程中的能量变化可用上图表示 |
D. 的平衡常数 的平衡常数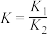 |
更新时间:2023-12-14 17:00:32
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】将TiO2、C、Cl2以一定的物质的量之比加入密闭容器中反应可生成TiCl4。可能发生的反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) TiCl4(g)+O2(g) ΔH1 =+172 kJ·mol−1
TiCl4(g)+O2(g) ΔH1 =+172 kJ·mol−1
反应Ⅱ:C(s)+O2(g)=CO2(g) ΔH2 =-393.5 kJ·mol−1
反应Ⅲ:2CO2(g)=2CO(g)+O2(g) ΔH3 = +564 kJ·mol−1
平衡时容器中气体的物质的量分数随温度变化如图所示(曲线a、b表示生成的CO2或CO)。下列说法不正确 的是

反应Ⅰ:TiO2(s)+2Cl2(g)
 TiCl4(g)+O2(g) ΔH1 =+172 kJ·mol−1
TiCl4(g)+O2(g) ΔH1 =+172 kJ·mol−1反应Ⅱ:C(s)+O2(g)=CO2(g) ΔH2 =-393.5 kJ·mol−1
反应Ⅲ:2CO2(g)=2CO(g)+O2(g) ΔH3 = +564 kJ·mol−1
平衡时容器中气体的物质的量分数随温度变化如图所示(曲线a、b表示生成的CO2或CO)。下列说法

| A.曲线a为CO |
| B.与仅加入TiO2、Cl2相比,碳的加入可提高TiCl4的产率 |
| C.TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH=-51 kJ·mol-1 |
| D.其他条件不变,增大压强,TiCl4的平衡产率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应a可实现氯的循环利用:
反应a:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)+115.6kJ
已知:i.
ii.H2O(g)=H2O(l)+44kJ
下列说法不正确的是
反应a:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)+115.6kJ
已知:i.

ii.H2O(g)=H2O(l)+44kJ
下列说法不正确的是
| A.反应a中反应物的总能量高于生成物的总能量 |
| B.反应a中涉及极性键、非极性键的断裂和生成 |
| C.4HCl(g)+O2(g)=2Cl2(g)+2H2O(l)+159.6kJ |
| D.断开1molH-O键与断开1molH-Cl键所需能量相差约为31.9kJ |
您最近一年使用:0次
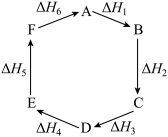
【推荐3】资料显示,块状大理石和盐酸反应:
CaCO3(s)+2HCl(aq) CO2(g)+H2O(l)+CaCl2(aq) ΔH;该反应的反应历程和部分物质的相对能量图如下:
CO2(g)+H2O(l)+CaCl2(aq) ΔH;该反应的反应历程和部分物质的相对能量图如下:

①CaCO3(s) CaCO3(aq) ΔH1
CaCO3(aq) ΔH1
②CaCO3(aq)=Ca2+(aq)+CO (aq) ΔH2
(aq) ΔH2
③CO (aq)+H+(aq)
(aq)+H+(aq) HCO
HCO (aq) ΔH3
(aq) ΔH3
④HCO (aq)+H+(aq)
(aq)+H+(aq) H2CO3(aq) ΔH4
H2CO3(aq) ΔH4
⑤H2CO3(aq) H2O(l) +CO2(aq) ΔH5
H2O(l) +CO2(aq) ΔH5
⑥CO2(aq) CO2(g) ΔH6
CO2(g) ΔH6
下列说法不正确 的是( )
CaCO3(s)+2HCl(aq)
 CO2(g)+H2O(l)+CaCl2(aq) ΔH;该反应的反应历程和部分物质的相对能量图如下:
CO2(g)+H2O(l)+CaCl2(aq) ΔH;该反应的反应历程和部分物质的相对能量图如下:
①CaCO3(s)
 CaCO3(aq) ΔH1
CaCO3(aq) ΔH1②CaCO3(aq)=Ca2+(aq)+CO
 (aq) ΔH2
(aq) ΔH2③CO
 (aq)+H+(aq)
(aq)+H+(aq) HCO
HCO (aq) ΔH3
(aq) ΔH3④HCO
 (aq)+H+(aq)
(aq)+H+(aq) H2CO3(aq) ΔH4
H2CO3(aq) ΔH4⑤H2CO3(aq)
 H2O(l) +CO2(aq) ΔH5
H2O(l) +CO2(aq) ΔH5⑥CO2(aq)
 CO2(g) ΔH6
CO2(g) ΔH6下列说法
| A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6 |
B.盐酸与块状大理石反应较慢,与c(CO )较小等因素有关 )较小等因素有关 |
C.一定温度下,CaCO3(s) Ca2+(aq)+CO Ca2+(aq)+CO (aq),达到平衡时, c(Ca2+)×c(CO (aq),达到平衡时, c(Ca2+)×c(CO )为常数 )为常数 |
D.CO (aq)+2H+(aq) (aq)+2H+(aq) H2O(l)+CO2(g) ΔH =(a-c)kJ·mol-1 H2O(l)+CO2(g) ΔH =(a-c)kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】N2O和CO气体均会造成环境污染,研究发现二者可在Pt2O+表面转化为无害气体,其反应进程及能量变化过程如图所示。

下列说法正确的是

下列说法正确的是
| A.N2O(g)+CO(g)=N2(g)+CO2(g)ΔH,ΔH=ΔH1+ΔH2 |
| B.使用催化剂可降低反应活化能,但不改变反应历程 |
| C.有催化剂条件下,反应的活化能等于E1+E2 |
D.Pt2O+与Pt2O 均为反应的催化剂 均为反应的催化剂 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
您最近一年使用:0次
【推荐1】工厂的氨氮废水可用电化学催化氧化法加以处理,其中NH3在电极表面的氧化过程的微观示意图如图:
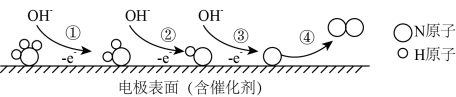
下列说法中,不正确的是

下列说法中,不正确的是
| A.过程①②均有N-H键断裂 |
B.过程③的电极反应式为: |
| C.过程④中没有非极性键形成 |
| D.催化剂可以降低该反应的活化能 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】已知反应S2O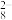 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是
(aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是
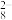 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是
(aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是
A.S2O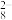 中硫元素显+7价 中硫元素显+7价 |
| B.反应速率与Fe3+浓度无关 |
C.由图可知氧化性:Fe3+>S2O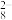 |
| D.若不加Fe3+,正反应的活化能比逆反应的小 |
您最近一年使用:0次


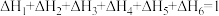
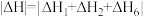

 的合成催化反应历程如图所示。下列说法错误的是
的合成催化反应历程如图所示。下列说法错误的是

 键和
键和 键的断裂
键的断裂

