氮氧化物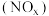 排放到大气中会严重危害人体健康。
排放到大气中会严重危害人体健康。 技术是去除NOx最为有效的技术之一,在催化剂条件下,以
技术是去除NOx最为有效的技术之一,在催化剂条件下,以 将尾气中NOx还原为
将尾气中NOx还原为 从而降低污染。
从而降低污染。
(1)反应Ⅰ:
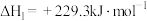
反应Ⅱ: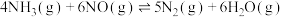
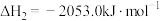
反应Ⅲ:

则:ΔH3=_______ kJ/mol
(2)用 去除尾气中的NOx,当
去除尾气中的NOx,当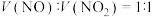 时,可发生“快速
时,可发生“快速 反应”,其有利于增大NOx脱除率。该反应的化学方程式为
反应”,其有利于增大NOx脱除率。该反应的化学方程式为___________ 。
(3)研究发现加入臭氧会发生反应: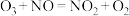 ,对
,对 技术去除NOx有一定的辅助作用。
技术去除NOx有一定的辅助作用。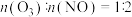 时,
时, 脱除率较高,原因是
脱除率较高,原因是___________ 。
(4)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入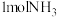 和
和 ,仅发生反应Ⅱ,起始压强为
,仅发生反应Ⅱ,起始压强为 ,反应过程中
,反应过程中 的物质的量如下表所示:
的物质的量如下表所示:
 内,该反应的平均反应速率
内,该反应的平均反应速率
___________ 。该反应的平衡常数
___________ (列出计算式)。
(5)利用隔膜电解法脱除废气中的 的装置如图所示。
的装置如图所示。
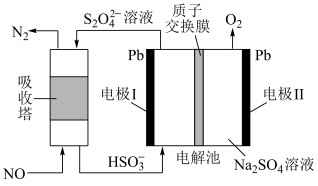
电解池中阴极的电极反应式为___________ 。当处理 的物质的量为
的物质的量为 时,阳极区电解质溶液的质量减少
时,阳极区电解质溶液的质量减少___________  。
。
 排放到大气中会严重危害人体健康。
排放到大气中会严重危害人体健康。 技术是去除NOx最为有效的技术之一,在催化剂条件下,以
技术是去除NOx最为有效的技术之一,在催化剂条件下,以 将尾气中NOx还原为
将尾气中NOx还原为 从而降低污染。
从而降低污染。(1)反应Ⅰ:

反应Ⅱ:
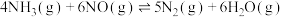
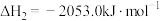
反应Ⅲ:


则:ΔH3=
(2)用
 去除尾气中的NOx,当
去除尾气中的NOx,当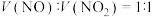 时,可发生“快速
时,可发生“快速 反应”,其有利于增大NOx脱除率。该反应的化学方程式为
反应”,其有利于增大NOx脱除率。该反应的化学方程式为(3)研究发现加入臭氧会发生反应:
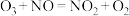 ,对
,对 技术去除NOx有一定的辅助作用。
技术去除NOx有一定的辅助作用。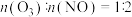 时,
时, 脱除率较高,原因是
脱除率较高,原因是(4)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入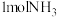 和
和 ,仅发生反应Ⅱ,起始压强为
,仅发生反应Ⅱ,起始压强为 ,反应过程中
,反应过程中 的物质的量如下表所示:
的物质的量如下表所示: | 0 | 5 | 10 | 20 | 30 | 40 |
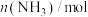 | 1 | 0.8 | 0.7 | 0.6 | 0.6 | 0.6 |
 内,该反应的平均反应速率
内,该反应的平均反应速率

(5)利用隔膜电解法脱除废气中的
 的装置如图所示。
的装置如图所示。
电解池中阴极的电极反应式为
 的物质的量为
的物质的量为 时,阳极区电解质溶液的质量减少
时,阳极区电解质溶液的质量减少 。
。
更新时间:2024-01-25 21:28:02
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氮氧化物( )是导致PM2.5、光化学烟雾、酸雨的主要物质之一,对燃煤工厂、汽车尾气进行脱硝处理有助于预防、消除上述环境问题。
)是导致PM2.5、光化学烟雾、酸雨的主要物质之一,对燃煤工厂、汽车尾气进行脱硝处理有助于预防、消除上述环境问题。
回答下列问题:
(1)臭氧是理想的烟气脱硝剂,脱硝过程涉及的部分反应如下:
①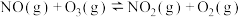
 kJ·mol
kJ·mol ;
;
②
 kJ·mol
kJ·mol ;
;
则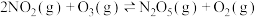

_______ ;若反应①的逆反应的活化能为212 kJ·mol 。则正反应的活化能为
。则正反应的活化能为_______ 。
(2)氨气也是一种优良的脱硝剂,在Ce-Ti固溶体催化剂存在下其中一种脱硝原理如图所示:

已知消耗0.l mol 时体系焓值降低40.7 kJ,写出该脱硝反应的热化学方程式:
时体系焓值降低40.7 kJ,写出该脱硝反应的热化学方程式:_______ 。有利于提高脱硝率(NO的平衡转化率)的条件是适度的_______ 填字母)。
A.高温低压 B.低温高压 C高温高压 D.低温低压
(3)甲烷是一种常用的脱硝剂,向某密闭容器中通入一定量x mol 、y mol
、y mol  ,控制适当条件使其发生反应:
,控制适当条件使其发生反应: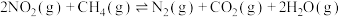
 ;测得经过10 min时
;测得经过10 min时 的转化率与温度(T)的关系如图所示。
的转化率与温度(T)的关系如图所示。

①该反应的
_______ (填“>”或“<”)0,a、b、c三点对应反应中,生成 的反应速率最快的是
的反应速率最快的是_______ ;一定温度下,当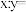
_______ 时,平衡体系中 体积分数达到最大。
体积分数达到最大。
②在T K条件下,向1 L恒容密闭容器中通入10 mol 和7 mol
和7 mol  ,经10 min反应达到平衡,平衡时
,经10 min反应达到平衡,平衡时 的体积分数为20%。则10 min内
的体积分数为20%。则10 min内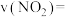
_______ mol·L ·min
·min ,反应的平衡常数
,反应的平衡常数
_______ 。
 )是导致PM2.5、光化学烟雾、酸雨的主要物质之一,对燃煤工厂、汽车尾气进行脱硝处理有助于预防、消除上述环境问题。
)是导致PM2.5、光化学烟雾、酸雨的主要物质之一,对燃煤工厂、汽车尾气进行脱硝处理有助于预防、消除上述环境问题。回答下列问题:
(1)臭氧是理想的烟气脱硝剂,脱硝过程涉及的部分反应如下:
①
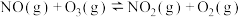
 kJ·mol
kJ·mol ;
;②

 kJ·mol
kJ·mol ;
;则
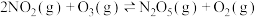

 。则正反应的活化能为
。则正反应的活化能为(2)氨气也是一种优良的脱硝剂,在Ce-Ti固溶体催化剂存在下其中一种脱硝原理如图所示:

已知消耗0.l mol
 时体系焓值降低40.7 kJ,写出该脱硝反应的热化学方程式:
时体系焓值降低40.7 kJ,写出该脱硝反应的热化学方程式:A.高温低压 B.低温高压 C高温高压 D.低温低压
(3)甲烷是一种常用的脱硝剂,向某密闭容器中通入一定量x mol
 、y mol
、y mol  ,控制适当条件使其发生反应:
,控制适当条件使其发生反应: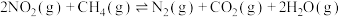
 ;测得经过10 min时
;测得经过10 min时 的转化率与温度(T)的关系如图所示。
的转化率与温度(T)的关系如图所示。
①该反应的

 的反应速率最快的是
的反应速率最快的是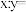
 体积分数达到最大。
体积分数达到最大。②在T K条件下,向1 L恒容密闭容器中通入10 mol
 和7 mol
和7 mol  ,经10 min反应达到平衡,平衡时
,经10 min反应达到平衡,平衡时 的体积分数为20%。则10 min内
的体积分数为20%。则10 min内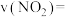
 ·min
·min ,反应的平衡常数
,反应的平衡常数
您最近一年使用:0次
【推荐2】碳中和是目前全球关注的热点。将 捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用
捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用 的方式。
的方式。
Ⅰ.实验室模拟由 与
与 合成甲醇。
合成甲醇。
(1)已知:
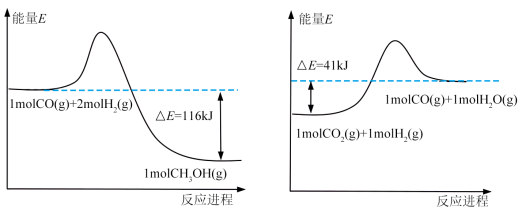
由上图反应,可知 的
的
_________  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将1mol 和3mol
和3mol 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
反应1: (主反应);
(主反应);
反应2:
①下列说法正确的是_________ 。(填字母代号)。
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内, 的平均反应速率为
的平均反应速率为_________  ;
;
③该温度下, 平衡常数K为
平衡常数K为_________ 。
Ⅱ.中国科学家通过电还原法将 转化为乙醇,其原理图如下所示。
转化为乙醇,其原理图如下所示。
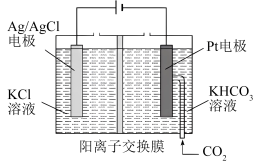
(3)则铂电极上的反应式为_________ 。
Ⅲ. 与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
(4)该反应化学方程式为_________ ,反应中常加入吸水剂,其目的是_________ 。
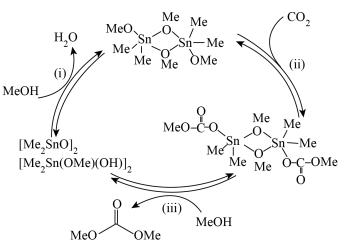
(5)下图表示的是甲醇(Me表示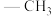 )与
)与 催化制备碳酸二甲酯的机理,按(ⅰ)(ⅱ)(ⅲ)步骤循环反应。图中
催化制备碳酸二甲酯的机理,按(ⅰ)(ⅱ)(ⅲ)步骤循环反应。图中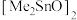 分子中只有一种类型的Me,该分子结构式为
分子中只有一种类型的Me,该分子结构式为_________ (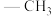 用Me表示)
用Me表示)
 捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用
捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用 的方式。
的方式。Ⅰ.实验室模拟由
 与
与 合成甲醇。
合成甲醇。(1)已知:

由上图反应,可知
 的
的
 。
。(2)实验室在1L密闭容器中进行模拟合成实验。将1mol
 和3mol
和3mol 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:反应1:
 (主反应);
(主反应);反应2:

| 物质\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
 | 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 |
 | 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内,
 的平均反应速率为
的平均反应速率为 ;
;③该温度下,
 平衡常数K为
平衡常数K为Ⅱ.中国科学家通过电还原法将
 转化为乙醇,其原理图如下所示。
转化为乙醇,其原理图如下所示。
(3)则铂电极上的反应式为
Ⅲ.
 与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。(4)该反应化学方程式为
(5)下图表示的是甲醇(Me表示
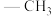 )与
)与 催化制备碳酸二甲酯的机理,按(ⅰ)(ⅱ)(ⅲ)步骤循环反应。图中
催化制备碳酸二甲酯的机理,按(ⅰ)(ⅱ)(ⅲ)步骤循环反应。图中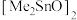 分子中只有一种类型的Me,该分子结构式为
分子中只有一种类型的Me,该分子结构式为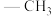 用Me表示)
用Me表示)
您最近一年使用:0次
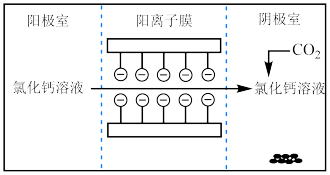
【推荐3】I.电解法可处理氯化钙废液同时,吸收CO2,装置如图所示。_______ 和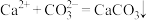 。
。
II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①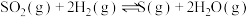

②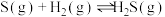

③

请用一个等式来表示三个反应的 之间的关系
之间的关系_______ 。
(3)反应③,在恒温、恒容的密闭容器中,充入 和
和 ,平衡常数
,平衡常数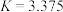 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为_______ 。
方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由_______ 。
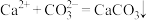 。
。II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①
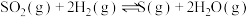

②
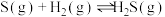

③


请用一个等式来表示三个反应的
 之间的关系
之间的关系(3)反应③,在恒温、恒容的密闭容器中,充入
 和
和 ,平衡常数
,平衡常数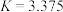 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化
 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
| A.温度越低,SO2的吸附量越高,SO2氧化反应速率越快 |
| B.已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 |
| C.原料中水蒸气的含量越大,脱硫速率一定越快 |
D.随着时间的推移,SO2吸附速率降低,可能是由于生成的 占据了吸附位点没及时脱出导致 占据了吸附位点没及时脱出导致 |
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,
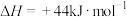 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式_____ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是_______ (填字母)。
A. B.容器内压强一定 C.气体平均相对分子,质量一定
B.容器内压强一定 C.气体平均相对分子,质量一定
D.气体密度一定 E. 的体积分数一定
的体积分数一定
②已知容器的容积为5L初始加入0.2mol 和0.6mol
和0.6mol ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为_______ 。
③温度不变,再加入 、
、 、
、 、
、 各0.2mol,则
各0.2mol,则
_______ 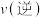 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。当
。当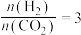 时,实验测得
时,实验测得 的平衡转化率檤温度及压强变化如图所示。
的平衡转化率檤温度及压强变化如图所示。
_______ (填“>”或“<”)0。
②图中压强(p)由大到小的顺序是_______ 。
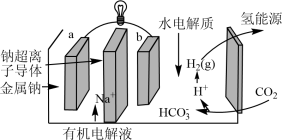
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。_______ 。
(1)已知
 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,
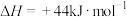 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定 C.气体平均相对分子,质量一定
B.容器内压强一定 C.气体平均相对分子,质量一定D.气体密度一定 E.
 的体积分数一定
的体积分数一定②已知容器的容积为5L初始加入0.2mol
 和0.6mol
和0.6mol ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为③温度不变,再加入
 、
、 、
、 、
、 各0.2mol,则
各0.2mol,则
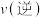 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。当
。当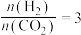 时,实验测得
时,实验测得 的平衡转化率檤温度及压强变化如图所示。
的平衡转化率檤温度及压强变化如图所示。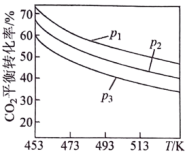

②图中压强(p)由大到小的顺序是
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】科学家开发新型催化剂实现了 对
对 (2-丁烯)的气相选择性氧化,其反应为:
(2-丁烯)的气相选择性氧化,其反应为:
反应I:

反应Ⅱ:

请回答:
(1)几种共价键的键能数据如下表所示。
已知 的结构式为
的结构式为 ,反应Ⅱ的正反应的活化能为
,反应Ⅱ的正反应的活化能为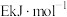 ,则反应Ⅱ的逆反应的活化能为
,则反应Ⅱ的逆反应的活化能为___________  。
。
(2)一定温度下,向恒压密闭容器中充入 和
和 ,发生反应I和反应Ⅱ,测得平衡体系中
,发生反应I和反应Ⅱ,测得平衡体系中 的体积分数与起始投料比
的体积分数与起始投料比 的关系如图所示。下列有关说法正确的是___________(填标号)。
的关系如图所示。下列有关说法正确的是___________(填标号)。
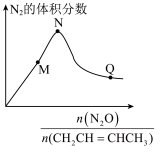
(3)在恒压密闭容器中充入2mol 和2mol
和2mol ,发生反应I和反应Ⅱ。
,发生反应I和反应Ⅱ。 压强下测得平衡时
压强下测得平衡时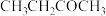 的选择性与温度的关系如图所示。X点时
的选择性与温度的关系如图所示。X点时 的平衡转化率为50%。(
的平衡转化率为50%。(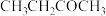 的选择性
的选择性 )。
)。

①其他条件不变,温度升高,平衡时 的选择性升高的原因是
的选择性升高的原因是___________ 。
②X点反应I的平衡常数 的数值为
的数值为_________ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
③若 ,请在图中画出
,请在图中画出 时,
时,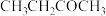 的选择性随温度升高的变化曲线
的选择性随温度升高的变化曲线___________ 。
 对
对 (2-丁烯)的气相选择性氧化,其反应为:
(2-丁烯)的气相选择性氧化,其反应为:反应I:


反应Ⅱ:
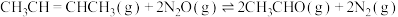

请回答:
(1)几种共价键的键能数据如下表所示。
| 共价键 |  |  |  |  |  |  |  |
键能 | 413 | 347 | 614 | 745 | 945 | 607 | 418 |
 的结构式为
的结构式为 ,反应Ⅱ的正反应的活化能为
,反应Ⅱ的正反应的活化能为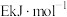 ,则反应Ⅱ的逆反应的活化能为
,则反应Ⅱ的逆反应的活化能为 。
。(2)一定温度下,向恒压密闭容器中充入
 和
和 ,发生反应I和反应Ⅱ,测得平衡体系中
,发生反应I和反应Ⅱ,测得平衡体系中 的体积分数与起始投料比
的体积分数与起始投料比 的关系如图所示。下列有关说法正确的是___________(填标号)。
的关系如图所示。下列有关说法正确的是___________(填标号)。
A.混合气体中 体积分数不再变化说明反应已达到平衡状态 体积分数不再变化说明反应已达到平衡状态 |
B.达到平衡时,体系中 的体积分数总是小于50% 的体积分数总是小于50% |
C.M、N、Q三点, 的转化率大小:N>M>Q 的转化率大小:N>M>Q |
D.从N到Q, 百分含量下降,是因为反应Ⅰ逆向移动 百分含量下降,是因为反应Ⅰ逆向移动 |
(3)在恒压密闭容器中充入2mol
 和2mol
和2mol ,发生反应I和反应Ⅱ。
,发生反应I和反应Ⅱ。 压强下测得平衡时
压强下测得平衡时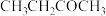 的选择性与温度的关系如图所示。X点时
的选择性与温度的关系如图所示。X点时 的平衡转化率为50%。(
的平衡转化率为50%。(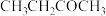 的选择性
的选择性 )。
)。
①其他条件不变,温度升高,平衡时
 的选择性升高的原因是
的选择性升高的原因是②X点反应I的平衡常数
 的数值为
的数值为③若
 ,请在图中画出
,请在图中画出 时,
时,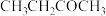 的选择性随温度升高的变化曲线
的选择性随温度升高的变化曲线
您最近一年使用:0次
【推荐3】大气污染物主要有氮的氧化物NOx和硫的氧化物SO2等。请回答下列问题:
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为_______ 。若上述反应过程中正反应的活化能Ea=112.2 kJ·mol-1,则逆反应的活化能Eb=_______ kJ·mol-1。

(2)研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g) + 6NO(g) 5N2(g)+6H2O(g) ΔH=﹣1810kJ·mol-1,相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图3所示。
5N2(g)+6H2O(g) ΔH=﹣1810kJ·mol-1,相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图3所示。

①在A、B、C三种催化剂的作用下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C) ,根据图3曲线,判断三种催化剂条件下,活化能由小到大的顺序为_______ 。
②在氨气足量时,反应在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图4所示,据图可知,在相同的时间内,温度对脱氮率的影响是_______ ,其可能的原因是_______ (已知A、B催化剂在此温度范围内不失效)。
(3)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知:2NO(g) +2CO(g) N2(g) +2CO2(g) ΔH <0. 若一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如下表所示:
N2(g) +2CO2(g) ΔH <0. 若一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如下表所示:
假设反应在恒定温度和标准压强下进行,则 =
=_______ (标准平衡常数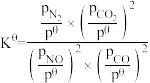 ,其中
,其中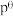 为标准压强(1 ×105 Pa),
为标准压强(1 ×105 Pa), 和
和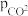 ,为各组分的平衡分压,如
,为各组分的平衡分压,如 =
=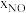 ·p总,p总为平衡总压,
·p总,p总为平衡总压,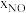 为平衡系统中NO的物质的量分数)。
为平衡系统中NO的物质的量分数)。
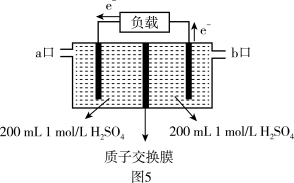
(4)用电化学原理可以减少SO2排放,其装置如图5所示。H2O2从_______ 口进入,右侧电极的电极反应式为_______ ,若电路中通过2mol电子时,负极区n(H2SO4)=_______ 。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为

(2)研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g) + 6NO(g)
 5N2(g)+6H2O(g) ΔH=﹣1810kJ·mol-1,相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图3所示。
5N2(g)+6H2O(g) ΔH=﹣1810kJ·mol-1,相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图3所示。
①在A、B、C三种催化剂的作用下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C) ,根据图3曲线,判断三种催化剂条件下,活化能由小到大的顺序为
②在氨气足量时,反应在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图4所示,据图可知,在相同的时间内,温度对脱氮率的影响是
(3)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知:2NO(g) +2CO(g)
 N2(g) +2CO2(g) ΔH <0. 若一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如下表所示:
N2(g) +2CO2(g) ΔH <0. 若一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如下表所示:| t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
| p/kPa | 400 | 370 | 346 | 330 | 320 | 320 |
 =
=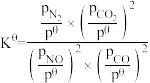 ,其中
,其中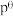 为标准压强(1 ×105 Pa),
为标准压强(1 ×105 Pa), 和
和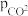 ,为各组分的平衡分压,如
,为各组分的平衡分压,如 =
=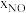 ·p总,p总为平衡总压,
·p总,p总为平衡总压,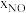 为平衡系统中NO的物质的量分数)。
为平衡系统中NO的物质的量分数)。(4)用电化学原理可以减少SO2排放,其装置如图5所示。H2O2从

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】丙烯腈( )是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈(
)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈( )、氢氰酸、丙烯醛(
)、氢氰酸、丙烯醛(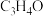 )等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈的主要反应如下:
)等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈的主要反应如下:
Ⅰ.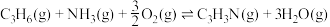

Ⅱ.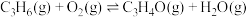

回答下列问题:
(1)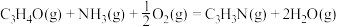

___________ kJ/mol。
(2)反应Ⅰ在______ (填“高温”“低温”或“任意”)条件下可自发进行;恒温恒容条件下,若容器内只发生反应Ⅰ,下列选项表明反应一定已经达平衡状态的是______ 。
A.容器内混合气体的密度不再变化 B.断裂1molN—H的同时断裂3molO—H
C.容器内压强不再变化 D.3v正(NH3)=2v逆(O2)
(3)恒温下,充入丙烯、氨气和氧气发生反应Ⅰ和Ⅱ,体系达到平衡后,若压缩容器体积,则反应Ⅱ的平衡移动方向为___________ (填“正反应方向”“逆反应方向”或“不移动”)。
(4)已知对于反应: ,T℃,压强为p的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amolC3H3N(g),bmolC3H4O(g),此时C3H6(g)的分压p(C3H6)=
,T℃,压强为p的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amolC3H3N(g),bmolC3H4O(g),此时C3H6(g)的分压p(C3H6)=_______________ (分压=总压×物质的量分数,用含a,b的代数式表示,下同);反应Ⅱ的Kp为___________ 。
(5)以丙烯腈为原料,利用电解原理合成已二腈 可减少氮氧化物的排放,其装置如图所示,pb电极为
可减少氮氧化物的排放,其装置如图所示,pb电极为______ 极,电解时Pb电极发生的电极反应式为___________ 。
 )是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈(
)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈( )、氢氰酸、丙烯醛(
)、氢氰酸、丙烯醛(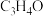 )等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈的主要反应如下:
)等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈的主要反应如下:Ⅰ.
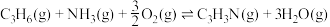

Ⅱ.
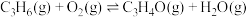

回答下列问题:
(1)
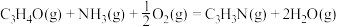

(2)反应Ⅰ在
A.容器内混合气体的密度不再变化 B.断裂1molN—H的同时断裂3molO—H
C.容器内压强不再变化 D.3v正(NH3)=2v逆(O2)
(3)恒温下,充入丙烯、氨气和氧气发生反应Ⅰ和Ⅱ,体系达到平衡后,若压缩容器体积,则反应Ⅱ的平衡移动方向为
(4)已知对于反应:
 ,T℃,压强为p的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amolC3H3N(g),bmolC3H4O(g),此时C3H6(g)的分压p(C3H6)=
,T℃,压强为p的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amolC3H3N(g),bmolC3H4O(g),此时C3H6(g)的分压p(C3H6)=(5)以丙烯腈为原料,利用电解原理合成已二腈
 可减少氮氧化物的排放,其装置如图所示,pb电极为
可减少氮氧化物的排放,其装置如图所示,pb电极为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】用 酸性溶液脱除
酸性溶液脱除 后的废液,通过控制电压电解得以再生
后的废液,通过控制电压电解得以再生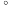 某同学使用石墨电极,在不同电压
某同学使用石墨电极,在不同电压 下电解
下电解 的
的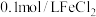 溶液,研究废液再生机理
溶液,研究废液再生机理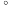 记录如下表。
记录如下表。 、
、 、
、 代表电压值:
代表电压值:
(1)用 酸性溶液脱除
酸性溶液脱除 的离子方程式为
的离子方程式为_______ 。
(2)I中, 产生的原因可能是
产生的原因可能是 在阳极放电,生成的
在阳极放电,生成的 将
将 氧化。写出在阳极放电的电极反应式
氧化。写出在阳极放电的电极反应式_______ 。
(3)由II推测, 产生的原因可能是
产生的原因可能是_______ 。
(4)II中虽未检测出 ,但
,但 在阳极是否放电仍需进一步验证电解
在阳极是否放电仍需进一步验证电解 的
的 溶液做对照实验,记录如下表。
溶液做对照实验,记录如下表。
① 溶液的浓度是
溶液的浓度是_______  。
。
②与II对比,得出两点结论:
第一:通过控制电压,证实了产生的 两种原因都成立。
两种原因都成立。
第二:_______ 。
 酸性溶液脱除
酸性溶液脱除 后的废液,通过控制电压电解得以再生
后的废液,通过控制电压电解得以再生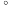 某同学使用石墨电极,在不同电压
某同学使用石墨电极,在不同电压 下电解
下电解 的
的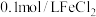 溶液,研究废液再生机理
溶液,研究废液再生机理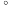 记录如下表。
记录如下表。 、
、 、
、 代表电压值:
代表电压值:
| 序号 | 电压 | 阳极现象 | 检验阳极产物 |
| I |  | 电极附近出现黄色,有气泡产生 | 有 、有 、有 |
| II |  | 电极附近出现黄色,无气泡产生 | 有 、无 、无 |
| III | 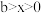 | 无明显变化 | 无 、无 、无 |
 酸性溶液脱除
酸性溶液脱除 的离子方程式为
的离子方程式为(2)I中,
 产生的原因可能是
产生的原因可能是 在阳极放电,生成的
在阳极放电,生成的 将
将 氧化。写出在阳极放电的电极反应式
氧化。写出在阳极放电的电极反应式(3)由II推测,
 产生的原因可能是
产生的原因可能是(4)II中虽未检测出
 ,但
,但 在阳极是否放电仍需进一步验证电解
在阳极是否放电仍需进一步验证电解 的
的 溶液做对照实验,记录如下表。
溶液做对照实验,记录如下表。| 序号 | 电压 | 阳极现象 | 检验阳极产物 |
| IV | 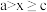 | 无明显变化 | 有 |
| V |  | 无明显变化 | 无 |
 溶液的浓度是
溶液的浓度是 。
。②与II对比,得出两点结论:
第一:通过控制电压,证实了产生的
 两种原因都成立。
两种原因都成立。第二:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】在铜冶炼过程中,产生的铜阳极泥富含金、银、硒、碲等。苏打熔炼法是一种从铜阳极泥中回收硒与碲的方法,且贵金属回收率高,工艺流程如图所示:

已知:①铜阳极泥中的铜主要以铜单质和硫化铜形态存在。
② 是白色固体,易溶于水且与水反应,
是白色固体,易溶于水且与水反应, 升华。
升华。
③ 是两性氧化物,微溶于水,易溶于强酸和强碱。
是两性氧化物,微溶于水,易溶于强酸和强碱。
(1)阳极泥在煅烧前进行粉碎的目的是_____ ,“煅烧”时阳极泥需在双层炉内氧化焙烧 ,其目的是
,其目的是_____ 。
(2)烟气中主要成分是 ,还原沉硒过程中发生反应的化学方程式为
,还原沉硒过程中发生反应的化学方程式为_____ 。
(3)向“水浸”后的溶液中加硫酸调 ,当
,当 为
为 时可沉出
时可沉出 ,此步骤要缓慢加入硫酸并不断搅拌的目的是
,此步骤要缓慢加入硫酸并不断搅拌的目的是_____ 。
(4) 经
经 溶液碱溶、电解得碲,碱溶时发生反应的离子方程式为
溶液碱溶、电解得碲,碱溶时发生反应的离子方程式为_____ 。
(5)情性电极电解制备碲的阴极电极反应式为_____ 。
(6)若电解法回收铜和碲均使用惰性电极,则可回收再利用的物质是_____ (写名称)。

已知:①铜阳极泥中的铜主要以铜单质和硫化铜形态存在。
②
 是白色固体,易溶于水且与水反应,
是白色固体,易溶于水且与水反应, 升华。
升华。③
 是两性氧化物,微溶于水,易溶于强酸和强碱。
是两性氧化物,微溶于水,易溶于强酸和强碱。(1)阳极泥在煅烧前进行粉碎的目的是
 ,其目的是
,其目的是(2)烟气中主要成分是
 ,还原沉硒过程中发生反应的化学方程式为
,还原沉硒过程中发生反应的化学方程式为(3)向“水浸”后的溶液中加硫酸调
 ,当
,当 为
为 时可沉出
时可沉出 ,此步骤要缓慢加入硫酸并不断搅拌的目的是
,此步骤要缓慢加入硫酸并不断搅拌的目的是(4)
 经
经 溶液碱溶、电解得碲,碱溶时发生反应的离子方程式为
溶液碱溶、电解得碲,碱溶时发生反应的离子方程式为(5)情性电极电解制备碲的阴极电极反应式为
(6)若电解法回收铜和碲均使用惰性电极,则可回收再利用的物质是
您最近一年使用:0次



