硒被誉为“生命元素”。亚硒酸钙(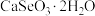 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
①含硒废料的主要成分是 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为 、
、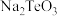 和
和 。
。
② 易溶于水,
易溶于水, 难溶于水。
难溶于水。
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为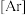
___________ 。
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是___________ (用离子方程式表示)。
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在 ),其主要原因是
),其主要原因是___________ 。
(4)硒酸分解制备 的副产物有
的副产物有___________ (填化学式)。
(5)已知 、
、 的熔点分别为
的熔点分别为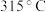 、
、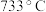 ,其熔点差异的主要原因是
,其熔点差异的主要原因是___________ 。
(6)测定 产品纯度。称取
产品纯度。称取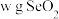 产品溶于水配制成
产品溶于水配制成 溶液,取
溶液,取 于锥形瓶中,加入足量
于锥形瓶中,加入足量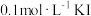 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用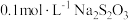 溶液滴定至终点时消耗
溶液滴定至终点时消耗 滴定液。发生有关反应:
滴定液。发生有关反应:
①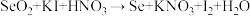 (未配平)
(未配平)
②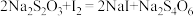
该 产品中硒元素的质量分数为
产品中硒元素的质量分数为___________ %。如果大量空气进入锥形瓶,可能导致测得的结果___________ (填“偏高”“偏低”或“无影响”)。
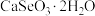 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题: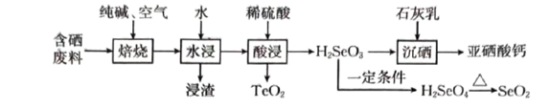
①含硒废料的主要成分是
 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为 、
、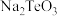 和
和 。
。②
 易溶于水,
易溶于水, 难溶于水。
难溶于水。(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为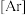
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在
 ),其主要原因是
),其主要原因是(4)硒酸分解制备
 的副产物有
的副产物有(5)已知
 、
、 的熔点分别为
的熔点分别为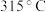 、
、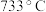 ,其熔点差异的主要原因是
,其熔点差异的主要原因是(6)测定
 产品纯度。称取
产品纯度。称取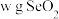 产品溶于水配制成
产品溶于水配制成 溶液,取
溶液,取 于锥形瓶中,加入足量
于锥形瓶中,加入足量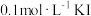 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用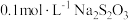 溶液滴定至终点时消耗
溶液滴定至终点时消耗 滴定液。发生有关反应:
滴定液。发生有关反应:①
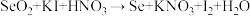 (未配平)
(未配平)②
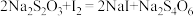
该
 产品中硒元素的质量分数为
产品中硒元素的质量分数为
23-24高三上·湖北十堰·阶段练习 查看更多[2]
更新时间:2024-02-04 10:20:45
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】硫酸亚铁是重要的化工原料
Ⅰ.
(1)由 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是___________ 。检验晶体中 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加___________ (填试剂)。
(2) 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含 的浊液,离子方程式是
的浊液,离子方程式是___________ 。
Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下:
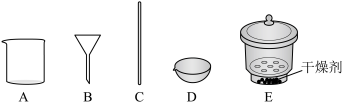
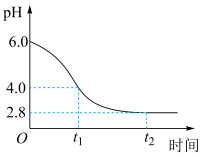
(3)若在实验室完成上述制备,不需要使用的仪器是___________ 。 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
② 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是___________ 。
(5)判断流程中产品洗涤干净的方法是___________ 。
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。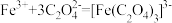 ,
,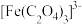 不与稀碱液反应。
不与稀碱液反应。
①在溶液c中滴加NaOH标准溶液,使用的指示剂为___________ 。
②若实验时加入了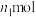 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为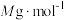 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ (用含w、 、
、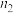 、M的代数式表示)。
、M的代数式表示)。
③测定时,若滴入 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”“偏小”或“无影响”)。
Ⅰ.
(1)由
 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加(2)
 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含 的浊液,离子方程式是
的浊液,离子方程式是Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以
 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下: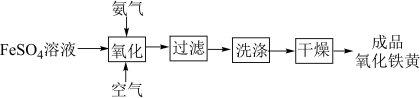
(3)若在实验室完成上述制备,不需要使用的仪器是
 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为②
 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是(5)判断流程中产品洗涤干净的方法是
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。
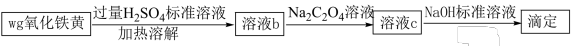
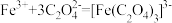 ,
,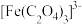 不与稀碱液反应。
不与稀碱液反应。①在溶液c中滴加NaOH标准溶液,使用的指示剂为
②若实验时加入了
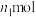 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为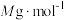 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为 、
、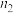 、M的代数式表示)。
、M的代数式表示)。③测定时,若滴入
 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】甘氨酸亚铁[(H2NCH2COO)2Fe]是一种复合补血营养剂。实验室用绿矾(FeSO4•7H2O)为原料制备甘氨酸亚铁,有关物质性质如下:
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中缓慢加入200mL1.1mol•L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
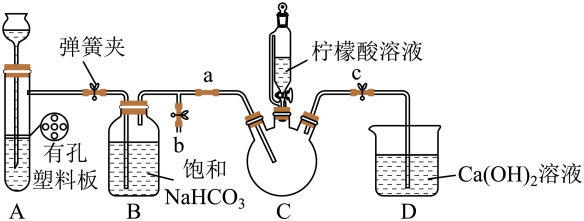
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,必须用到的玻璃仪器有___ 。
(2)实验II中:生成沉淀的离子方程式为___ 。
(3)实验III中:①检查装置A的气密性的方法是___ 。
②A中反应产生的气体是___ ,C中空气排净时,D中现象是___ 。
③洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___ (填标号)。
a.乙醇 b.热水 c.柠檬酸溶液
(4)甘氨酸亚铁中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率(已经被氧化的Fe2+的质量与Fe2+总质量的比值)超过10.00%即不能再服用。实验室用Ce(SO4)2溶液对甘氨酸亚铁中的Fe2+进行滴定[假设样品中其他成分不与Ce(SO4)2反应],滴定过程发生如下反应:Ce4++Fe2+=Fe3++Ce3+。
①称量6.0g甘氨酸亚铁样品,将其全部溶于稀H2SO4中,配制成250mL溶液。取10.00mL配制好的溶液于锥形瓶中,用0.10mol•L-1的Ce(SO4)2溶液滴定,以邻二氮菲为指示剂。当溶液由红色变为浅蓝色且半分钟之内不恢复原色,滴定达到终点。若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率___ (填“偏高”“偏低”或“不变”)
②滴定时消耗9.60mLCe(SO4)2溶液,则甘氨酸亚铁样品中Fe2+的氧化率为___ 。
| 甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中缓慢加入200mL1.1mol•L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,必须用到的玻璃仪器有
(2)实验II中:生成沉淀的离子方程式为
(3)实验III中:①检查装置A的气密性的方法是
②A中反应产生的气体是
③洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是
a.乙醇 b.热水 c.柠檬酸溶液
(4)甘氨酸亚铁中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率(已经被氧化的Fe2+的质量与Fe2+总质量的比值)超过10.00%即不能再服用。实验室用Ce(SO4)2溶液对甘氨酸亚铁中的Fe2+进行滴定[假设样品中其他成分不与Ce(SO4)2反应],滴定过程发生如下反应:Ce4++Fe2+=Fe3++Ce3+。
①称量6.0g甘氨酸亚铁样品,将其全部溶于稀H2SO4中,配制成250mL溶液。取10.00mL配制好的溶液于锥形瓶中,用0.10mol•L-1的Ce(SO4)2溶液滴定,以邻二氮菲为指示剂。当溶液由红色变为浅蓝色且半分钟之内不恢复原色,滴定达到终点。若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率
②滴定时消耗9.60mLCe(SO4)2溶液,则甘氨酸亚铁样品中Fe2+的氧化率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】已知;S4N4是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与SCl2反应制得。某同学利用如图装置制取SCl2,然后制取S4N4。已知:SCl2为红棕色液体,有刺激性臭味,熔点:-78℃,沸点:60℃,易水解。
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成SCl2。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得S4N4。
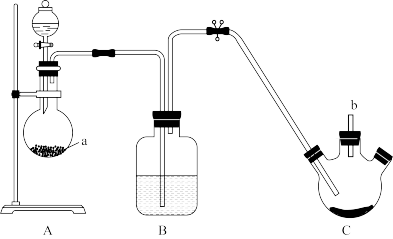
试回答下列问题。
(1)仪器a的名称为___________ ,a中次氯酸钙可与浓盐酸反应制备氯气,写出反应的化学方程式___________ 。
(2)B装置中应选择的试剂为___________ 。
(3)制取SCl2过程中,b导管末端连接装有碱石灰的干燥管,其作用是___________ 。
(4)向制得的SCl2中通入NH3,生成S4N4的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式___________ 。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象___________ 。
(5)S4N4在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定S4N4的纯度。称取5.00gS4N4;样品,加入NaOH溶液,并加热,释放出的氨气用足量100mL1.00mol·L-1硼酸溶液吸收[反应方程式为2NH3+4H3BO3=(NH4)2B4O7+5H2O,假定反应过程中溶液体积不变]。取反应后的硼酸溶液25.00mL,以甲基红-亚甲蓝为指示剂,再用1.00mol·L-1的盐酸[滴定反应方程式为(NH4)2B4O7+2HCl+5H2O =2NH4Cl+4H3BO3]进行滴定,达到滴定终点时消耗盐酸体积为20.00mL。则制得的S4N4的纯度为___________ 。
(6)下列实验操作可能使S4N4测定结果偏低的是___________ 。
A.滴定时未用盐酸标准溶液润洗滴定管
B.滴定前滴定管尖嘴处无气泡,滴定结束后产生气泡
C.读数时,滴定前平视,滴定后仰视
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成SCl2。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得S4N4。

试回答下列问题。
(1)仪器a的名称为
(2)B装置中应选择的试剂为
(3)制取SCl2过程中,b导管末端连接装有碱石灰的干燥管,其作用是
(4)向制得的SCl2中通入NH3,生成S4N4的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
(5)S4N4在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定S4N4的纯度。称取5.00gS4N4;样品,加入NaOH溶液,并加热,释放出的氨气用足量100mL1.00mol·L-1硼酸溶液吸收[反应方程式为2NH3+4H3BO3=(NH4)2B4O7+5H2O,假定反应过程中溶液体积不变]。取反应后的硼酸溶液25.00mL,以甲基红-亚甲蓝为指示剂,再用1.00mol·L-1的盐酸[滴定反应方程式为(NH4)2B4O7+2HCl+5H2O =2NH4Cl+4H3BO3]进行滴定,达到滴定终点时消耗盐酸体积为20.00mL。则制得的S4N4的纯度为
(6)下列实验操作可能使S4N4测定结果偏低的是
A.滴定时未用盐酸标准溶液润洗滴定管
B.滴定前滴定管尖嘴处无气泡,滴定结束后产生气泡
C.读数时,滴定前平视,滴定后仰视
您最近一年使用:0次
【推荐1】三元锂电池性能优异、能量密度高,正极材料包含了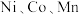 三种过渡金属氧化物。
三种过渡金属氧化物。
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
(2)在稀氨水介质中, 与丁二酮肟(分子式为
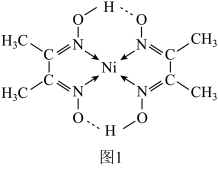
与丁二酮肟(分子式为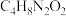 )反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为
)反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为___________ 。
(3) 易与氨水反应生成的
易与氨水反应生成的 ,
, 配位数为
配位数为___________ , 形成配合物后
形成配合物后 键角会
键角会___________ (填“变大”、“变小”或“不变”),原因是___________ 。
(4)下表是 与
与 的部分电离能数据,解释
的部分电离能数据,解释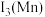 大于
大于 的主要原因:
的主要原因:___________ 。
(5) 与
与 类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为
类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为___________ ,已知该晶胞的底边长为 ,高为
,高为 ,则晶胞密度为
,则晶胞密度为___________  。
。

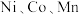 三种过渡金属氧化物。
三种过渡金属氧化物。(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)在稀氨水介质中,
 与丁二酮肟(分子式为
与丁二酮肟(分子式为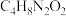 )反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为
)反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为
(3)
 易与氨水反应生成的
易与氨水反应生成的 ,
, 配位数为
配位数为 形成配合物后
形成配合物后 键角会
键角会(4)下表是
 与
与 的部分电离能数据,解释
的部分电离能数据,解释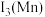 大于
大于 的主要原因:
的主要原因:| 元素 |  |  |
第二电离能 ( (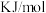 ) ) | 1561 | 1509 |
第三电离能 ( (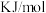 ) ) | 2957 | 3248 |
 与
与 类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为
类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为 ,高为
,高为 ,则晶胞密度为
,则晶胞密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.物质的光学性质在科研中有重要的用途,回答下列问题:
一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为________ 。
(2)均为平面结构的吡咯( )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为________ ,原因是________ 。
Ⅱ.分析如图晶胞结构特点,回答下列问题:
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。已知:立方氮化硼密度为 ,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为
,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为 ,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为
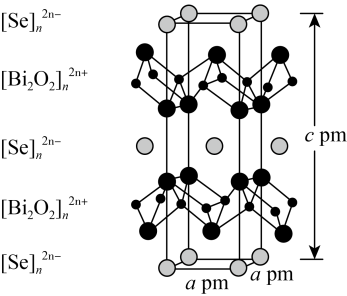
,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为________ (列出计算式即可,不用化简)。 层与带负电的
层与带负电的 层交替堆积。据此推断硒氧化铋的化学式为
层交替堆积。据此推断硒氧化铋的化学式为________ 。晶胞棱边夹角均为90°,则晶体密度的计算式为________  。
。
一种比率光声探针M与
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示: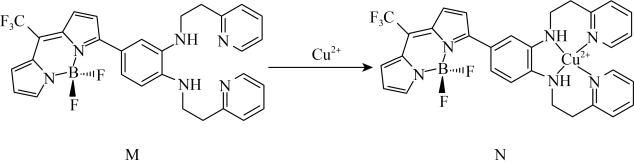
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.分析如图晶胞结构特点,回答下列问题:
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。已知:立方氮化硼密度为
 ,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为
,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为 ,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为
,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为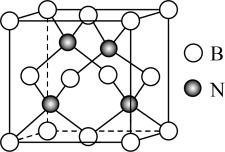
 层与带负电的
层与带负电的 层交替堆积。据此推断硒氧化铋的化学式为
层交替堆积。据此推断硒氧化铋的化学式为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】Cu元素及其化合物在工农业生产和生活中有重要用途。请回答下列问题:
(1)基态Cu原子价电子排布图为_______ ,其原子核外电子占据的最高能层符号为_______ ,其最外层电子的电子云形状为_______ 。
(2)4-甲基咪唑(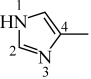 )可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
①4-甲基咪唑中_______ (填“1”或“3”)号N原子更容易与Cu+形成配位键。4-甲基咪唑中的大π键可表示为_______ 。(表示方法为Π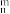 ,n为成环原子个数,m为形成大π键电子个数)
,n为成环原子个数,m为形成大π键电子个数)
②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是_______ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。
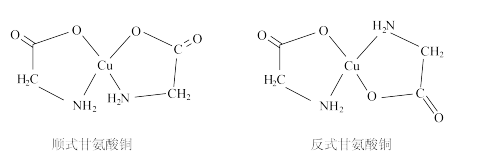
甘氨酸铜中铜原子的杂化方式为_______ 。(填“sp3”或“dsp2”)
(4)O、Cu、Ba、Hg形成的某种超导材料的晶胞如图所示。设阿伏加德罗常数的值为NA,该晶体的密度为_______ g•cm-3。

(1)基态Cu原子价电子排布图为
(2)4-甲基咪唑(
 )可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。①4-甲基咪唑中
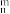 ,n为成环原子个数,m为形成大π键电子个数)
,n为成环原子个数,m为形成大π键电子个数)②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。

甘氨酸铜中铜原子的杂化方式为
(4)O、Cu、Ba、Hg形成的某种超导材料的晶胞如图所示。设阿伏加德罗常数的值为NA,该晶体的密度为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】以硼镁矿(主要成分为难溶于水的Mg2B2O5,并含有一定量Fe2O3、Al2O3、SiO2、CaO等)为原料生产硼酸(H3BO3)的工艺流程如图,回答下列问题:

已知:ⅰ. 25℃时,Ksp[Mg(OH)2] = 1.8 × 10−10,Ka(H3BO3) = 5.8 × 10−10;
ⅱ. H3BO3的溶解度随温度的变化如下表。
(1)“溶浸”后,溶浸液中硼元素存在的形式为B(OH)−,同时产生的气体可以使湿润的红色石蕊试纸变蓝,则该过程中Mg2B2O5发生反应的离子方程式为_______ 。
(2)滤渣的主要成分除了Al2O3、Fe2O3外,还有_______ (填化学式)。
(3)为了获得H3BO3粗品,步骤“①调pH = 3.5”最适宜加入的物质是_______。
(4)若“②调pH”为11(该步骤在25℃下进行),Mg2+_______ (填“有”或“没有”) 沉淀完全?
(5)若“②调pH”使用氨,该流程中可循环利用的物质还有_______ (填化学式)。
(6)H3BO3粗品的提纯方法为_______ 。
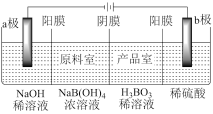
(7)H3BO3也可以通过电解NaB(OH)4的方法获得,电解原理如图所示。电解过程中a极区pH的变化为_______ (填“增大”“减小”或“不变”),产品室中发生反应的离子方程式为_______ 。

已知:ⅰ. 25℃时,Ksp[Mg(OH)2] = 1.8 × 10−10,Ka(H3BO3) = 5.8 × 10−10;
ⅱ. H3BO3的溶解度随温度的变化如下表。
| 温度/℃ | 0 | 30 | 80 | 100 |
| 溶解度/(g/100g水) | 2.66 | 6.60 | 23.75 | 40.25 |
(1)“溶浸”后,溶浸液中硼元素存在的形式为B(OH)−,同时产生的气体可以使湿润的红色石蕊试纸变蓝,则该过程中Mg2B2O5发生反应的离子方程式为
(2)滤渣的主要成分除了Al2O3、Fe2O3外,还有
(3)为了获得H3BO3粗品,步骤“①调pH = 3.5”最适宜加入的物质是_______。
| A.氨水 | B.硫酸 | C.硫酸钠 | D.氢氧化钠 |
(4)若“②调pH”为11(该步骤在25℃下进行),Mg2+
(5)若“②调pH”使用氨,该流程中可循环利用的物质还有
(6)H3BO3粗品的提纯方法为
(7)H3BO3也可以通过电解NaB(OH)4的方法获得,电解原理如图所示。电解过程中a极区pH的变化为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】废旧锂电池的正极材料中含有镍、钴、锂、铝等金属元素。一种从废旧锂电池中回收镍、钴、锂制备相应产品的工艺流程如下: 、Li+、Al3+的形式存在。
、Li+、Al3+的形式存在。
②碳酸锂的溶解度(g/L)见表。
(1)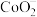 中Co的化合价是
中Co的化合价是___________ 。
(2)某研究团队对“酸浸”条件做了大量研究,得出如下图示,根据下图选择适宜的浸取条件:___________ ;温度___________ ;浸出时间___________ 。
(3)“还原”操作时主要反应的离子方程式为___________ ;经检测,浸出液中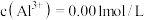 ,“除铝”时,要使Al3+开始沉淀,pH值应大于
,“除铝”时,要使Al3+开始沉淀,pH值应大于___________ 。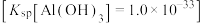
(4)实验室“萃取”操作需要在___________ (填仪器名称)中进行;“沉钴”的离子方程式为___________ 。
(5)“一系列操作”为___________ 、洗涤、干燥。
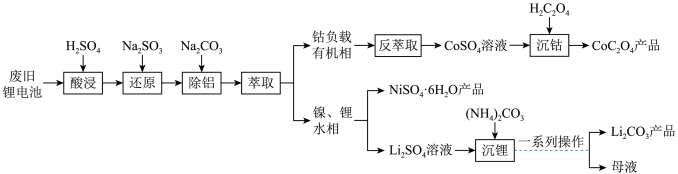
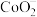 、Li+、Al3+的形式存在。
、Li+、Al3+的形式存在。②碳酸锂的溶解度(g/L)见表。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)
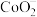 中Co的化合价是
中Co的化合价是(2)某研究团队对“酸浸”条件做了大量研究,得出如下图示,根据下图选择适宜的浸取条件:

(3)“还原”操作时主要反应的离子方程式为
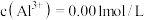 ,“除铝”时,要使Al3+开始沉淀,pH值应大于
,“除铝”时,要使Al3+开始沉淀,pH值应大于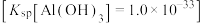
(4)实验室“萃取”操作需要在
(5)“一系列操作”为
您最近一年使用:0次
【推荐3】新能源汽车发展迅速,其中比亚迪公司的刀片电池极大提高了汽车的续航里程。该电池使用的磷酸铁锂可使用硫铁矿烧渣(主要成分是 ,含少量
,含少量 、
、 和CaO)为原料,通过以下工艺制备:
和CaO)为原料,通过以下工艺制备:
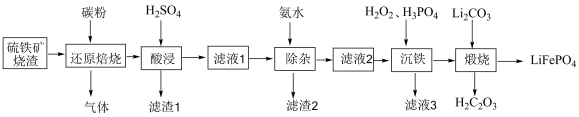
(1)写出 的电子式:
的电子式:___________ ,滤渣2的主要成分为___________ (填化学式)。
(2)“酸浸”需要控制温度为65~80℃,原因是___________ 。
(3)“沉铁”步骤反应的离子方程式为___________ 。
(4)若“滤液2”中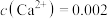 mol/L,加入双氧水和磷酸后,溶液的体积增加了一倍,使
mol/L,加入双氧水和磷酸后,溶液的体积增加了一倍,使 恰好完全沉淀即溶液中
恰好完全沉淀即溶液中 mol/L,此时“沉铁”得到的
mol/L,此时“沉铁”得到的 沉淀中
沉淀中___________ (选填“含有”或“不含有”)含钙杂质。已知: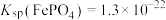 ,
,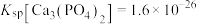 。
。
(5)为提高原料利用率,“滤液3”可返回___________ 步骤。
(6)磷酸铁锂电池是环保型电池,电池总反应的总反应为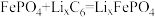
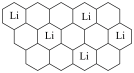
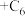 。某石墨嵌入化合物(锂元素嵌入石墨的两层间)的平面结构如下图,则
。某石墨嵌入化合物(锂元素嵌入石墨的两层间)的平面结构如下图,则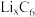 中的x=
中的x=___________ 。
用该电池电解精炼铜,当电池负极质量改变10.5 g时,得到精铜38.4 g,则电子利用率为___________ %。
 ,含少量
,含少量 、
、 和CaO)为原料,通过以下工艺制备:
和CaO)为原料,通过以下工艺制备:
(1)写出
 的电子式:
的电子式:(2)“酸浸”需要控制温度为65~80℃,原因是
(3)“沉铁”步骤反应的离子方程式为
(4)若“滤液2”中
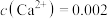 mol/L,加入双氧水和磷酸后,溶液的体积增加了一倍,使
mol/L,加入双氧水和磷酸后,溶液的体积增加了一倍,使 恰好完全沉淀即溶液中
恰好完全沉淀即溶液中 mol/L,此时“沉铁”得到的
mol/L,此时“沉铁”得到的 沉淀中
沉淀中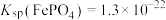 ,
,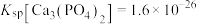 。
。(5)为提高原料利用率,“滤液3”可返回
(6)磷酸铁锂电池是环保型电池,电池总反应的总反应为
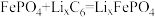
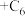 。某石墨嵌入化合物(锂元素嵌入石墨的两层间)的平面结构如下图,则
。某石墨嵌入化合物(锂元素嵌入石墨的两层间)的平面结构如下图,则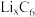 中的x=
中的x=
用该电池电解精炼铜,当电池负极质量改变10.5 g时,得到精铜38.4 g,则电子利用率为
您最近一年使用:0次



