2SO2(g)+O2(g) 2SO3(g)
2SO3(g)  =-198kJ·mol-1,在V2O5存在时,该反应机理为:
=-198kJ·mol-1,在V2O5存在时,该反应机理为:
V2O5+SO2→2VO2+SO3(快)
4VO2+O2→2V2O5(慢)
下列说法正确的是
 2SO3(g)
2SO3(g)  =-198kJ·mol-1,在V2O5存在时,该反应机理为:
=-198kJ·mol-1,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快)
4VO2+O2→2V2O5(慢)
下列说法正确的是
| A.升高温度,逆反应速率增加,正反应速率降低 |
| B.该反应逆反应的活化能大于198kJ·mol-1 |
| C.VO2是该反应的催化剂 |
| D.为提高反应速率,适当增加SO2浓度比适当增加O2浓度效果好 |
更新时间:2024-03-05 09:54:21
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】一定条件, 反应的反应历程如图所示,描述正确的是
反应的反应历程如图所示,描述正确的是

 反应的反应历程如图所示,描述正确的是
反应的反应历程如图所示,描述正确的是
| A.该反应历程中共有两个基元反应 |
| B.总反应速率快慢由第二步决定 |
C.第二步基元反应为 |
| D.该反应所有基元反应均为吸热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列有关活化分子和活化能的说法不正确的是
| A.发生有效碰撞的分子一定是活化分子 |
| B.升高温度,可增加单位体积活化分子数 |
| C.增加气体反应物的浓度,可以提高活化分子百分数 |
| D.使用催化剂可降低活化能,提高单位体积活化分子百分数 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】苯乙炔在某光催化材料上转化为苯乙烯的反应历程如图,Ph为苯基,下列说法错误的是
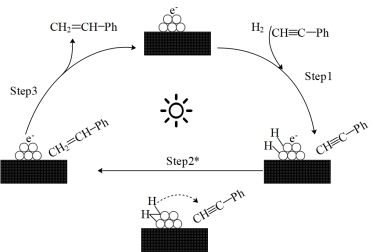

A.该反应的总方程式为 |
| B.该反应将太阳能转化为化学能 |
| C.苯乙炔经催化反应后转化率得到了提高 |
| D.催化剂表面无极性键的断裂,但有极性键的形成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: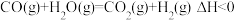 ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
,在低温下获得高转化率与高反应速率。反应过程示意图如下:
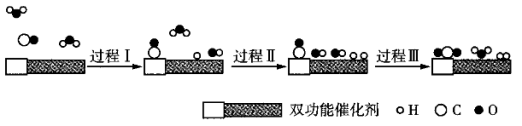
下列说法错误的是
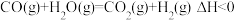 ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法错误的是
| A.若起始时的水分子为HDO,则生成的氢气可能有三种分子 |
| B.过程Ⅰ、Ⅱ均为放热过程 |
| C.过程Ⅲ中形成了非极性共价键 |
D.使用催化剂不改变水煤气变换反应的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法不正确的是
| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L-1) | 0.80 | 0.40 | 0.20 | 0.10 | 0.050 |
| A.反应20min时,测得O2体积为224mL(标准状况) |
| B.20~40min,消耗H2O2的平均速率为0.010mol·L-1·min-1 |
| C.第30min时的瞬时速率小于第50min时的瞬时速率 |
| D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解 |
您最近一年使用:0次

 呈蓝色,
呈蓝色, 呈黄色。在
呈黄色。在 溶液中存在如下平衡
溶液中存在如下平衡
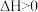 ,下列叙述正确的是
,下列叙述正确的是

