回答下列问题:
(1)根据对角线规则,在周期表中,与Li化学性质最相似的邻族元素是___________ (填元素符号),MgO的电子式为___________ 。
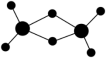
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于___________ 分子(填“极性”或“非极性”)分子,分子中Al采取___________ 杂化。
(3)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号)。
(4)PH3的电子式为___________ ;NH3很容易液化(常用作冷库中的制冷剂),而同主族的PH3却没有这样的性质,原因是:___________ 。
(5)亚硒酸钠(Na2SeO3)能消除加速人体衰老的活性氧,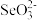 的键角小于气态分子SeO3的原因是:
的键角小于气态分子SeO3的原因是:___________ 。
(1)根据对角线规则,在周期表中,与Li化学性质最相似的邻族元素是
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于

(3)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号)。
A.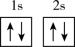 | B.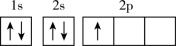 |
C.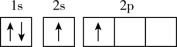 | D.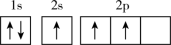 |
(5)亚硒酸钠(Na2SeO3)能消除加速人体衰老的活性氧,
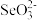 的键角小于气态分子SeO3的原因是:
的键角小于气态分子SeO3的原因是:
更新时间:2024-04-09 17:50:04
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s 2;B原子的L电子层的p能级上有一个空轨道;C元素的基态原子最外层有3个未成对电子,次外层有2个电子;D的原子的2p轨道上有l个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为_______ 。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为_____ ;分子的VSEPR模型名称为_____ ;阴离子的立体构型为______ 。
(2)A的元素符号为_____ ;G的价电子排布式为_______ 。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_____ ; BD分子的结构式为_____ , 1molBD分子中含有_____ molπ键。
(4)B、C、D、E原子两两相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子_______ (写分子式)。
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s 2;B原子的L电子层的p能级上有一个空轨道;C元素的基态原子最外层有3个未成对电子,次外层有2个电子;D的原子的2p轨道上有l个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为
(2)A的元素符号为
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为
(4)B、C、D、E原子两两相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】分析下图信息,结合所学内容解答问题。

回答下列问题:
(1)①第三周期某元素的前5个电子的电离能如图1所示。该元素是_______  填元素符号
填元素符号 ,判断依据是
,判断依据是_______ 。
②第二周期元素的第一电离能 随原子序数
随原子序数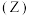 的变化情况如图6,I1随Z的递增而呈增大趋势,导致
的变化情况如图6,I1随Z的递增而呈增大趋势,导致 在a点出现齿峰的原因是
在a点出现齿峰的原因是 _______ 。
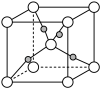
③铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_______ 个镁原子最近且等距离。
(2)配合物 的熔点
的熔点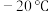 ,沸点
,沸点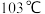 ,可用于制备纯铁。
,可用于制备纯铁。 的结构如图3所示。下列关于
的结构如图3所示。下列关于 说法不正确的是
说法不正确的是_______ 。
A. 是非极性分子,含有δ键和π键
是非极性分子,含有δ键和π键
B. 中Fe原子的配体与
中Fe原子的配体与 互为等电子体
互为等电子体
C.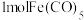 含有
含有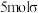 键
键
D. 反应中没有新化学键生成
反应中没有新化学键生成
(3)独立的 分子中,
分子中, 键键角为
键键角为 如图4所示是
如图4所示是 的部分结构以及其中
的部分结构以及其中 键键角。请解释
键键角。请解释 离子中
离子中 键角变为
键角变为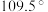 的原因是
的原因是_______ 。根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是_______ 。
A. 和
和 B.
B. 和
和 C.
C. 和ClO3- D.
和ClO3- D. 和
和
(4)已知立方BN晶体硬度很大,其原因是_______ ;其晶胞结构如图5所示,设晶胞中最近的B、N原子之间的距离为anm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为_______  列式即可,用含a、
列式即可,用含a、 的代数式表示
的代数式表示
(5)在某种含镁、镍、碳3种元素的超导材料晶体中,镁原子和镍原子一起以立方最密堆积方式形成有序结构.结构中的两种八面体空隙,一种完全由镍原子构成,另一种由镍原子和镁原子共同构成,碳原子只填充在由镍原子构成的八面体空隙中,晶胞如图7所示。
①组成该晶体的化学式为_______ 。
②完全由镍原子构成的八面体空隙与由镍原子和镁原子共同构成的八面体空隙的数量比为_______ 。
③若取碳原子为晶胞顶点,则镍原子位于晶胞的_______ 位置。

回答下列问题:
(1)①第三周期某元素的前5个电子的电离能如图1所示。该元素是
 填元素符号
填元素符号 ,判断依据是
,判断依据是②第二周期元素的第一电离能
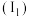 随原子序数
随原子序数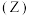 的变化情况如图6,I1随Z的递增而呈增大趋势,导致
的变化情况如图6,I1随Z的递增而呈增大趋势,导致 在a点出现齿峰的原因是
在a点出现齿峰的原因是 ③铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有
(2)配合物
 的熔点
的熔点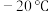 ,沸点
,沸点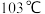 ,可用于制备纯铁。
,可用于制备纯铁。 的结构如图3所示。下列关于
的结构如图3所示。下列关于 说法不正确的是
说法不正确的是A.
 是非极性分子,含有δ键和π键
是非极性分子,含有δ键和π键 B.
 中Fe原子的配体与
中Fe原子的配体与 互为等电子体
互为等电子体C.
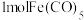 含有
含有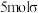 键
键D.
 反应中没有新化学键生成
反应中没有新化学键生成(3)独立的
 分子中,
分子中, 键键角为
键键角为 如图4所示是
如图4所示是 的部分结构以及其中
的部分结构以及其中 键键角。请解释
键键角。请解释 离子中
离子中 键角变为
键角变为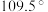 的原因是
的原因是A.
 和
和 B.
B. 和
和 C.
C. 和ClO3- D.
和ClO3- D. 和
和
(4)已知立方BN晶体硬度很大,其原因是
 ,则晶体的密度为
,则晶体的密度为 列式即可,用含a、
列式即可,用含a、 的代数式表示
的代数式表示
(5)在某种含镁、镍、碳3种元素的超导材料晶体中,镁原子和镍原子一起以立方最密堆积方式形成有序结构.结构中的两种八面体空隙,一种完全由镍原子构成,另一种由镍原子和镁原子共同构成,碳原子只填充在由镍原子构成的八面体空隙中,晶胞如图7所示。
①组成该晶体的化学式为
②完全由镍原子构成的八面体空隙与由镍原子和镁原子共同构成的八面体空隙的数量比为
③若取碳原子为晶胞顶点,则镍原子位于晶胞的
您最近一年使用:0次
【推荐3】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___ 族。写出其基态原子的电子排布式_____ 。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___ .(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____ 。
(3)Cu可以和EDA(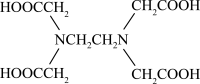 )形成配合物,其中碳原子的杂化方式是
)形成配合物,其中碳原子的杂化方式是____ ,其中C、N、O的电负性由大到小的顺序是_____ 。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____ ,O2中σ和 键的个数比是
键的个数比是______ 。
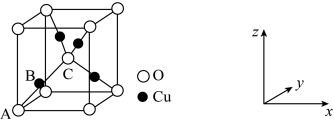
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是( ,
, ,
, ),则B原子坐标是
),则B原子坐标是____ 。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加 德罗常数的值,则氧化亚铜的密度是_____ g·cm—3
(1)Cu位于周期表第四周期第
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子
②第二电离能Cu比Ni高,原因是
(3)Cu可以和EDA(
 )形成配合物,其中碳原子的杂化方式是
)形成配合物,其中碳原子的杂化方式是(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为
 键的个数比是
键的个数比是②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(
 ,
, ,
, ),则B原子坐标是
),则B原子坐标是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
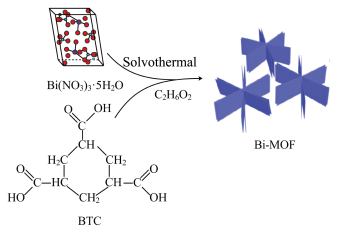
【推荐1】MOFs是一种有机-无机杂化材料,兼有无机材料的刚性和有机材料的柔性特征,使其在现代材料研究方面呈现出巨大的发展潜力和诱人的发展前景。我国科研的工作者制备了一种铋基MOF复合材料,可用作高性能的钾离子电池的负极材料,如图所示。回答下列问题:_______ 区。 中阴离子的键角比H2O
中阴离子的键角比H2O_______ (填“大”或“小”);BTC的核磁共振氢谱中有_______ 组峰。
(2)该反应的有机溶剂化学式为 (乙二醇),易溶于水和乙醇的原因是
(乙二醇),易溶于水和乙醇的原因是_______ 。
(3)MOF材料与ZnO复合可制备荧光材料ZnO-MOF,ZnO溶于氨水生成 ,1mol
,1mol 共有
共有_______ mol的σ键, 也可溶于氨水生成
也可溶于氨水生成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(4)MOF还可以电催化还原 ,装置原理如图所示。电极b的电极反应式为
,装置原理如图所示。电极b的电极反应式为_______ ,电极a上生成1mol 时,理论上可还原标准状况下
时,理论上可还原标准状况下_______ 1L 。
。
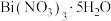 中阴离子的键角比H2O
中阴离子的键角比H2O(2)该反应的有机溶剂化学式为
 (乙二醇),易溶于水和乙醇的原因是
(乙二醇),易溶于水和乙醇的原因是(3)MOF材料与ZnO复合可制备荧光材料ZnO-MOF,ZnO溶于氨水生成
 ,1mol
,1mol 共有
共有 也可溶于氨水生成
也可溶于氨水生成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)MOF还可以电催化还原
 ,装置原理如图所示。电极b的电极反应式为
,装置原理如图所示。电极b的电极反应式为 时,理论上可还原标准状况下
时,理论上可还原标准状况下 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】锆英石常用于耐火材料,其矿砂常与钛铁矿、金红石、石英共生。针对相关物质,回答下列问题:
(1)下列基态Si原子结构的表示方法中最能准确表示出电子排布特点的是___________ (填标号,下同),能够表示出原子核构成特点的是___________ 。

(2)SiO2晶体常伴生于各种矿石中,其晶体结构中,最小的环上有___________ 个原子;Si与C元素位于同一主族,比较SiO2与CO2的键角大小:SiO2___________ CO2(填写“大于”、“小于”或“等于”),原因是________________ 。
(3)钛铁矿经过H2SO4、HNO3等多种物质处理后会生成TiOSO2等中间产物。
①TiOSO4晶体中存在_______ (填标号)。
A.离子键 B.σ键 C.π键 D.氢键
②H2SO4为粘稠状、难挥发性的强酸,而HNO3是易挥发性的强酸,其原因是___________ 。
(4)FeO是离子晶体,其晶格能可通过下图的Born- Haber循环计算得到。

可知,O原子的第一电子亲和能为________ kJ·mo-1,FeO晶格能为________ kJ·mo-1。
(5)ZrO2可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。已知晶胞参数为anm,阿伏伽德罗常数的值为NA,则Zr原子与O原子之间的最短距离为___________ nm;ZrO2的密度为___________ g·cm-3(列式表示)。

(1)下列基态Si原子结构的表示方法中最能准确表示出电子排布特点的是

(2)SiO2晶体常伴生于各种矿石中,其晶体结构中,最小的环上有
(3)钛铁矿经过H2SO4、HNO3等多种物质处理后会生成TiOSO2等中间产物。
①TiOSO4晶体中存在
A.离子键 B.σ键 C.π键 D.氢键
②H2SO4为粘稠状、难挥发性的强酸,而HNO3是易挥发性的强酸,其原因是
(4)FeO是离子晶体,其晶格能可通过下图的Born- Haber循环计算得到。

可知,O原子的第一电子亲和能为
(5)ZrO2可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。已知晶胞参数为anm,阿伏伽德罗常数的值为NA,则Zr原子与O原子之间的最短距离为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。

回答问题:
(1)基态锰原子的价层电子排布式为_______ 。
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为_______ 。
(3)第一电离能的大小:C_______ O(填“大于”或“小于”)。
(4) 中碳原子的杂化轨道类型是
中碳原子的杂化轨道类型是_______ ,写出一种与具有相同空间结构的-1价无机酸根离子的化学式_______ 。
(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为_______ 。
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是_______ 。


回答问题:
(1)基态锰原子的价层电子排布式为
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为
(3)第一电离能的大小:C
(4)
 中碳原子的杂化轨道类型是
中碳原子的杂化轨道类型是(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分别为:A_______ ;B_______ ;C_______ ;BC2是由_______ 键组成的_______ (填“极性”或“非极性”)分子。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Co、Ni、C等多种元素。请回答:
(1)基态铁的价电子排布式为___________ ,基态Ni原子的电子空间运动状态有___________ 种。
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是___________ 分子(填“极性”或“非极性”)。
(3)实验室常用 KSCN溶液检验 。
。
①与KSCN中与SCN-互为等电子体的非极性分子的化学式为___________
②SCN-中碳原子杂化类型为___________ 。
(4)配位化合物[Co(NH3)5Cl]Cl2中心原子Co的配位数为___________ ,配位原子为___________ 。1mol[Co(NH3)5Cl]Cl2中σ键___________ mol。
(5)已知Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为___________ g·cm-3(NA 表示阿伏加德罗常数的值,只需列出表达式)。
(1)基态铁的价电子排布式为
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是
(3)实验室常用 KSCN溶液检验
 。
。①与KSCN中与SCN-互为等电子体的非极性分子的化学式为
②SCN-中碳原子杂化类型为
(4)配位化合物[Co(NH3)5Cl]Cl2中心原子Co的配位数为
(5)已知Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】H2S与CO2在高温下发生反应:H2S(g)+CO2(g)  COS(g)+H2O(g)。在350℃时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应10min达到平衡,测得水的物质的量分数为0.02。
COS(g)+H2O(g)。在350℃时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应10min达到平衡,测得水的物质的量分数为0.02。
(1)0~10min,H2S的平均反应速率v=_______ 。
(2)在360℃重复实验,平衡后水的物质的量分数为0.03,H2S的平衡转化率α_______ (选填“增大”或“减小”),该反应是_______ 反应。(选填“吸热”或“放热”)
(3)CO2和COS结构相似,沸点:CO2_______ COS(选填“>”或“<”),解释理由_______ 。
 COS(g)+H2O(g)。在350℃时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应10min达到平衡,测得水的物质的量分数为0.02。
COS(g)+H2O(g)。在350℃时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应10min达到平衡,测得水的物质的量分数为0.02。(1)0~10min,H2S的平均反应速率v=
(2)在360℃重复实验,平衡后水的物质的量分数为0.03,H2S的平衡转化率α
(3)CO2和COS结构相似,沸点:CO2
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硅是地壳中储量仅次于氧的元素,在自然界中主要以 和硅酸盐的形式存在。
和硅酸盐的形式存在。
(1)基态硅原子的价电子排布式为___________ 。
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次为___________ 。
(3)晶态 的晶胞如图。
的晶胞如图。

①硅原子的杂化方式为___________ 。
②已知 晶胞的棱长均为a pm,则
晶胞的棱长均为a pm,则 晶体的密度
晶体的密度
___________  (列出计算式)。
(列出计算式)。
(4)硅元素最高价氧化物对应的水化物为原硅酸 。
。
资料:原硅酸()( )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
①原硅酸钠 溶液吸收空气中的
溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:___________ 。
②从结构的角度解释 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:___________ 。
 和硅酸盐的形式存在。
和硅酸盐的形式存在。(1)基态硅原子的价电子排布式为
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次为
(3)晶态
 的晶胞如图。
的晶胞如图。
①硅原子的杂化方式为
②已知
 晶胞的棱长均为a pm,则
晶胞的棱长均为a pm,则 晶体的密度
晶体的密度
 (列出计算式)。
(列出计算式)。(4)硅元素最高价氧化物对应的水化物为原硅酸
 。
。资料:原硅酸()(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠
 溶液吸收空气中的
溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:②从结构的角度解释
 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】乙醛能够发生下列反应:
Cu2O+




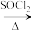
(1)Mn2+的基态电子排布式为____ 。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为___ 。
(3)CH3CHO分子中氧原子的轨道杂化类型是____ 。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____ 。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____ 。
(6)如图表示Cu2O的晶胞,Cu+的配位数是____ 。
Cu2O+





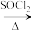
(1)Mn2+的基态电子排布式为
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为
(3)CH3CHO分子中氧原子的轨道杂化类型是
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
(6)如图表示Cu2O的晶胞,Cu+的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)下列物质的结构或性质与氢键无关的是___________(填字母)。
(2)HCN是直线形分子,HCN是___________ (填“极性”或“非极性”)分子。
(3)金刚石、石墨、 和石墨烯都是碳的同素异形体。
和石墨烯都是碳的同素异形体。
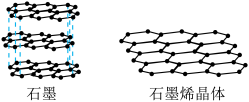
①石墨晶体中存在的作用力有___________ ,还有金属键的特性。
② 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是___________ 。
③石墨烯即单层石墨,石墨烯中碳原子的杂化轨道类型为___________ ;碳原子和碳碳键的个数比是___________ 。
④12g石墨烯中,所含的 键数目为
键数目为___________ 。
(1)下列物质的结构或性质与氢键无关的是___________(填字母)。
| A.水的沸点 | B.氢化钠的摩尔质量 |
| C.乙醇在水中的溶解度 | D.DNA的双螺旋结构 |
(3)金刚石、石墨、
 和石墨烯都是碳的同素异形体。
和石墨烯都是碳的同素异形体。
①石墨晶体中存在的作用力有
②
 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是③石墨烯即单层石墨,石墨烯中碳原子的杂化轨道类型为
④12g石墨烯中,所含的
 键数目为
键数目为
您最近一年使用:0次



