I.现有下列物质:
①NaCl晶体 ②液态SO2 ③冰醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 ⑨氯水 ⑩纯盐酸,请用以上物质回答下列问题。
(1)属于强电解质且在上述状态下能导电的是___________ ;属于弱电解质的是___________ ;属于非电解质,但溶于水后的水溶液能导电的是___________ 。
II.密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g) 2NH3 (g)
2NH3 (g)  H <0。
H <0。
(2)①达到平衡时, 充入N2并保持体积不变,平衡将___________ 移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将___________ 移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将___________ 移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡___________ 移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量___________ ,密度___________ (变大、变小或不变)。
⑥当反应达到平衡时,N2和H2的浓度比是___________ ;N2和H2的转化率比是___________ 。
①NaCl晶体 ②液态SO2 ③冰醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 ⑨氯水 ⑩纯盐酸,请用以上物质回答下列问题。
(1)属于强电解质且在上述状态下能导电的是
II.密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)
 2NH3 (g)
2NH3 (g)  H <0。
H <0。(2)①达到平衡时, 充入N2并保持体积不变,平衡将
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量
⑥当反应达到平衡时,N2和H2的浓度比是
更新时间:2024-05-04 16:31:16
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】在一恒容密闭容器中进行反应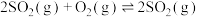
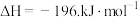 。
。 的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
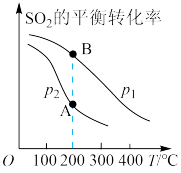
(1)压强: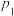
_______ (填“>”“=”或“<”)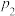 。
。
(2)升高温度,平衡常数_______ (填“增大”“不变”或“减小”)。
(3)200℃时,将一定量的 和
和 充入体积为2L的恒容密闭容器中,经10min后测得各物质的物质的量如下表示:
充入体积为2L的恒容密闭容器中,经10min后测得各物质的物质的量如下表示:
①10min内该反应的反应速率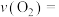
_______ ,起始时充入 的物质的量为
的物质的量为_______ 。
②下列能说明该反应达到化学平衡状态的是_______ (填序号)。
a. 和
和 的体积比保持不变 b.混合气体的密度保持不变
的体积比保持不变 b.混合气体的密度保持不变
c.体系的压强保持不变 d. 和
和 物质的量之和保持不变
物质的量之和保持不变
③当反应放出98.0kJ热量时,测得该反应达平衡状态,该温度下 的转化率为
的转化率为_______ 。
(4)400℃时,将等量的 和
和 分别在两个容积相等的容器中反应,并达到平衡。在这过程中,甲容器保持容积不变,乙容器保持压强不变,若甲容器中
分别在两个容积相等的容器中反应,并达到平衡。在这过程中,甲容器保持容积不变,乙容器保持压强不变,若甲容器中 的体积分数为p%,则乙容器中
的体积分数为p%,则乙容器中 的体积分数
的体积分数_______ (填序号)。
a.等于p% b.大于p% c.小于p% d.无法判断
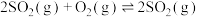
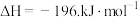 。
。 的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
(1)压强:
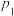
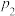 。
。(2)升高温度,平衡常数
(3)200℃时,将一定量的
 和
和 充入体积为2L的恒容密闭容器中,经10min后测得各物质的物质的量如下表示:
充入体积为2L的恒容密闭容器中,经10min后测得各物质的物质的量如下表示:| 气体 |  |  |  |
| 物质的量/mol | 1.6 | 1.8 | 0.4 |
①10min内该反应的反应速率
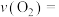
 的物质的量为
的物质的量为②下列能说明该反应达到化学平衡状态的是
a.
 和
和 的体积比保持不变 b.混合气体的密度保持不变
的体积比保持不变 b.混合气体的密度保持不变c.体系的压强保持不变 d.
 和
和 物质的量之和保持不变
物质的量之和保持不变③当反应放出98.0kJ热量时,测得该反应达平衡状态,该温度下
 的转化率为
的转化率为(4)400℃时,将等量的
 和
和 分别在两个容积相等的容器中反应,并达到平衡。在这过程中,甲容器保持容积不变,乙容器保持压强不变,若甲容器中
分别在两个容积相等的容器中反应,并达到平衡。在这过程中,甲容器保持容积不变,乙容器保持压强不变,若甲容器中 的体积分数为p%,则乙容器中
的体积分数为p%,则乙容器中 的体积分数
的体积分数a.等于p% b.大于p% c.小于p% d.无法判断
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)下列关于H2S和SO2的说法正确的是______________
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内CO的反应速率为_________________ 。
②该反应平衡常数______________ (保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________ (填“正向”、“逆向”或“不”)移动。判断理由是_________________ 。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______ 0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO
 N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:①这段时间内CO的反应速率为
②该反应平衡常数
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将
④若升温发现体系气体平均相对分子质量增大,则该反应的△H
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__ (填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%
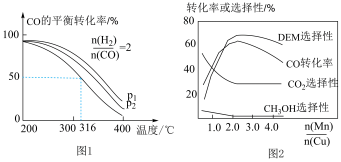
②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____ 时最有利于二甲醚的合成。
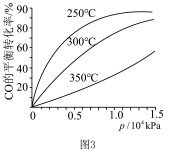
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____ 0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______ 。
(3)在一定条件下,可发生反应6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
根据上表中数据分析:
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__ (填“增大”、“减小”或“不变”)。
②该反应的正反应为___ 热反应(填“吸”或“放”)。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%

②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH
(3)在一定条件下,可发生反应6H2(g)+2CO2(g)
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。| 500K | 600K | 700K | 800K | |
| n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
| n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
| n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率
②该反应的正反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,有浓度均为0.1mol∙L﹣1的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是_______ (填序号)。
(2)①中各离子浓度由大到小的顺序是_______ 。
(3)④的水解平衡常数Kh=_______ mol/L。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_______ ④(填“>”、“<”、“=”)。
(5)25℃时,测得HCN和NaCN的混合溶液的pH=11,则 约为
约为_______ 。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:_______ 。
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10﹣10 | Ka1=4×10﹣7 Ka2=5.6×10﹣11 | Ka=1.7×10﹣5 |
(1)这4种溶液pH由大到小的顺序是
(2)①中各离子浓度由大到小的顺序是
(3)④的水解平衡常数Kh=
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(5)25℃时,测得HCN和NaCN的混合溶液的pH=11,则
 约为
约为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按要求回答下列问题:
(1)现有物质:①硫酸铜晶体 ②碳酸钙固体 ③纯磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧固态苛性钾 ⑨氨水 ⑩熟石灰固体 ⑪蔗糖 ⑫液态CH3COOH,按下列要求填空:
属于非电解质的是___________ (填序号,下同);属于强电解质的是___________ ;能导电的是___________ 。
(2)书写硫代硫酸钠与稀硫酸反应的化学方程式___________
(3)已知反应2HI(g) H2(g)+I2(g) △H= +11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g) △H= +11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
(4)常温下,pH=4的盐酸与pH=10的NaOH溶液以体积比11∶9混合后,溶液的pH=___________ 。
(5)在一定温度下,有a. 氢氧化钠 b.氢氧化钡 c.氨水三种碱溶液。(用a、b、c填空)
①同体积、同物质的量浓度的三种碱,中和同物质的量浓度的盐酸溶液的能力由大到小的顺序是___________ 。
②将pH值相同的三种碱溶液均加水稀释至原来的100倍后,pH值由大到小的顺序是___________ 。
(1)现有物质:①硫酸铜晶体 ②碳酸钙固体 ③纯磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧固态苛性钾 ⑨氨水 ⑩熟石灰固体 ⑪蔗糖 ⑫液态CH3COOH,按下列要求填空:
属于非电解质的是
(2)书写硫代硫酸钠与稀硫酸反应的化学方程式
(3)已知反应2HI(g)
 H2(g)+I2(g) △H= +11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g) △H= +11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为(4)常温下,pH=4的盐酸与pH=10的NaOH溶液以体积比11∶9混合后,溶液的pH=
(5)在一定温度下,有a. 氢氧化钠 b.氢氧化钡 c.氨水三种碱溶液。(用a、b、c填空)
①同体积、同物质的量浓度的三种碱,中和同物质的量浓度的盐酸溶液的能力由大到小的顺序是
②将pH值相同的三种碱溶液均加水稀释至原来的100倍后,pH值由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】根据中学化学常见的①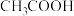 、②
、②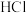 、③
、③ 三种溶液,请用A~H
三种溶液,请用A~H
A.①<②<③ B.①=②=③ C.①>②>③
D.①<②=③ E.①=③>② F.①>②=③
G.①=②>③ H.①=②<③
(1)当它们 相同时,其物质的量浓度关系是
相同时,其物质的量浓度关系是______ 。
(2)当它们的物质的量浓度相同时,其 的关系是
的关系是______ 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种醋溶液的体积关系为______ 。
(4)当它们 相同、体积相同时,同时加入锌,则开始时反应速率
相同、体积相同时,同时加入锌,则开始时反应速率______ ,若产生相同体积的气体(相同状况),所需时间______ 。
(5)将 相同的三种酸均稀释10倍后,
相同的三种酸均稀释10倍后, 关系为
关系为______ 。
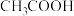 、②
、②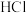 、③
、③ 三种溶液,请用A~H
三种溶液,请用A~HA.①<②<③ B.①=②=③ C.①>②>③
D.①<②=③ E.①=③>② F.①>②=③
G.①=②>③ H.①=②<③
(1)当它们
 相同时,其物质的量浓度关系是
相同时,其物质的量浓度关系是(2)当它们的物质的量浓度相同时,其
 的关系是
的关系是(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种醋溶液的体积关系为
(4)当它们
 相同、体积相同时,同时加入锌,则开始时反应速率
相同、体积相同时,同时加入锌,则开始时反应速率(5)将
 相同的三种酸均稀释10倍后,
相同的三种酸均稀释10倍后, 关系为
关系为
您最近一年使用:0次



