在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g) a Z(g) + W(g)
a Z(g) + W(g)  H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为___________ ;此反应的逆反应 S
S___________ 0 (填﹤,﹥,﹦)。
(2)下列说法中能说明该反应达到了化学平衡状态的是___________ 。
A.容器内压强一定
B.v(X)正=2 v (Y)逆
C.容器内Z分子数一定
D.容器内气体的质量一定
E.容器内气体的密度一定
F.X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小到开始时的85%,则反应中放出的热量为___________ kJ。
(4)已知:该反应的平衡常数随温度的变化如下表:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡,X的平衡转化率为50%,则该温度为___________ ℃。
 a Z(g) + W(g)
a Z(g) + W(g)  H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则(1)化学计量数a的值为
 S
S(2)下列说法中能说明该反应达到了化学平衡状态的是
A.容器内压强一定
B.v(X)正=2 v (Y)逆
C.容器内Z分子数一定
D.容器内气体的质量一定
E.容器内气体的密度一定
F.X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小到开始时的85%,则反应中放出的热量为
(4)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 150 | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
更新时间:2024-05-07 15:33:37
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______ 。
(2)该反应为_______ 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是_______。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______ ℃。
Ⅱ.完成下列填空
(5)Na2CO3的水溶液呈_______ 性,原因是(用离子方程式表示):_______ ;
(6)实验室在配制Na2CO3溶液时,为了抑制水解应向溶液中加入少量的_______ 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K =
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是_______。
| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
Ⅱ.完成下列填空
(5)Na2CO3的水溶液呈
(6)实验室在配制Na2CO3溶液时,为了抑制水解应向溶液中加入少量的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】每到冬季,雾霾天气肆虐京津冀等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________ (填代号)。
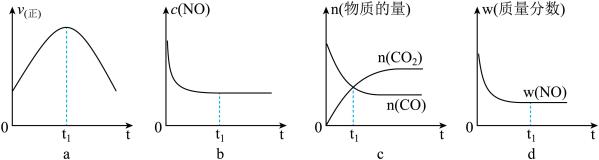
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)⇌N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式__________________ 。
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式_________________________ 。
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为_______ 。
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是_________ 。
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)⇌N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇( )是一种可再生能源,由
)是一种可再生能源,由 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:
反应Ⅰ: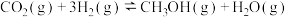
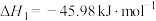
反应Ⅱ: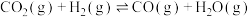

反应Ⅲ:
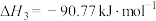
(1)反应Ⅱ的
___________ 。
(2)反应Ⅲ的
___________ 0(填“<”或“>”),在_______ (填“较低温度”、“较高温度”或“任何温度”)下能够自发进行。
(3)恒温、恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是_______ 。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C. 、
、 、
、 、
、 的物质的量之比为1∶3∶1∶1
的物质的量之比为1∶3∶1∶1
(4)对于反应Ⅰ,不同温度对 的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是___________(双选)。
的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是___________(双选)。
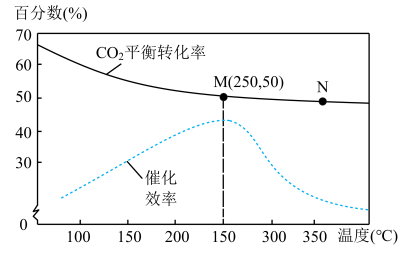
(5)若在1L密闭容器中充入3 mol  和1mol
和1mol  发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为
发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为___________ ;该温度下,反应的平衡常数
___________ 。(均保留3位有效数字)
(6)反应Ⅱ在其他条件相同、不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后, 的转化率随反应温度的变化如右图所示。请判断a点所处的状态是不是化学平衡状态并说明理由
的转化率随反应温度的变化如右图所示。请判断a点所处的状态是不是化学平衡状态并说明理由___________ 。

 )是一种可再生能源,由
)是一种可再生能源,由 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:反应Ⅰ:
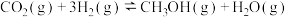
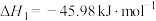
反应Ⅱ:
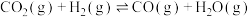

反应Ⅲ:

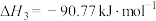
(1)反应Ⅱ的

(2)反应Ⅲ的

(3)恒温、恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.
 、
、 、
、 、
、 的物质的量之比为1∶3∶1∶1
的物质的量之比为1∶3∶1∶1(4)对于反应Ⅰ,不同温度对
 的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是___________(双选)。
的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是___________(双选)。
A.其他条件不变,若不使用催化剂,则250℃时 的平衡转化率仍位于M 的平衡转化率仍位于M |
| B.温度低于250℃时,随温度升高甲醇的产率增大 |
| C.使用催化剂时,M点的正反应速率小于N点的正反应速率 |
| D.M点时平衡常数比N点时平衡常数大 |
 和1mol
和1mol  发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为
发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为
(6)反应Ⅱ在其他条件相同、不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,
 的转化率随反应温度的变化如右图所示。请判断a点所处的状态是不是化学平衡状态并说明理由
的转化率随反应温度的变化如右图所示。请判断a点所处的状态是不是化学平衡状态并说明理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】合成氨工艺是人工固氮的重要途径,解决了数亿人口生存问题。
(1)已知:①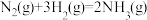

②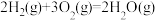
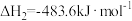
则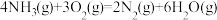
 =
=___________ 。
(2)合成氨的反应历程可表示如下:
第一步: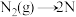 ;
;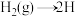 (慢反应)
(慢反应)
第二步: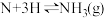 (快反应)
(快反应)
①第一步反应的活化能大于第二步反应的活化能,理由是___________ 。
②下列关于合成氨反应条件的选择是利用勒夏特列原理的是___________ (填序号)。
A.选择400~500℃ B.选择10~30MPa
C.使用铁触媒催化剂 D.及时分离出氨气
(3)在一定条件下,向某反应容器中充入1molN2、3molH2在不同温度下反应,平衡体系中氨的物质的量分数随压强变化的曲线如图所示:
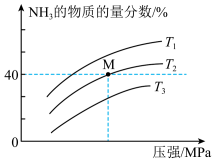
温度T1、T2、T3由高到低的顺序为___________ ,M点H2的平衡转化率为___________ %(保留一位小数)。
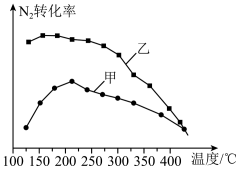
(4)将N2和H2以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定N2的转化率,结果如图所示,则在合理的温度下,___________ (填“甲”或“乙”)催化剂的催化效果更好。
(1)已知:①
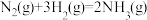

②
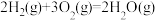
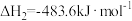
则
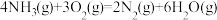
 =
=(2)合成氨的反应历程可表示如下:
第一步:
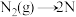 ;
;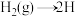 (慢反应)
(慢反应)第二步:
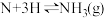 (快反应)
(快反应)①第一步反应的活化能大于第二步反应的活化能,理由是
②下列关于合成氨反应条件的选择是利用勒夏特列原理的是
A.选择400~500℃ B.选择10~30MPa
C.使用铁触媒催化剂 D.及时分离出氨气
(3)在一定条件下,向某反应容器中充入1molN2、3molH2在不同温度下反应,平衡体系中氨的物质的量分数随压强变化的曲线如图所示:

温度T1、T2、T3由高到低的顺序为
(4)将N2和H2以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定N2的转化率,结果如图所示,则在合理的温度下,

您最近一年使用:0次
【推荐2】甲烷水蒸气催化重整是制备高纯氢的方法之一。
甲烷水蒸气催化重整发生如下反应:
反应i.
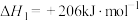
反应ⅱ.

(1)已知反应ⅱ中相关的化学键键能数据如下:
由此计算
______  。
。
(2)为了提高反应中甲烷的平衡转化率,理论上可采取的措施是______。
(3)把甲烷和水蒸气按物质的量之比1∶3通入反应器中,其他条件不变,在不同温度下探究CaO对平衡时干燥出口气中 物质的量分数的影响,结果如下:
物质的量分数的影响,结果如下:______ K(700℃)(填“大于”、“等于”或“小于”)。
②在400~600℃范围内,反应器中有CaO能大幅提高 物质的量分数,原因是
物质的量分数,原因是______ (用化学方程式表示)。
(4)某温度下,在体积为1L的容器中加入1mol 、3mol水蒸气进行催化重整反应,达到平衡时
、3mol水蒸气进行催化重整反应,达到平衡时 的总转化率为80%,CO的浓度为
的总转化率为80%,CO的浓度为 。
。 的平衡浓度为
的平衡浓度为______  ,反应i的平衡常数为
,反应i的平衡常数为______ 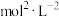 (保留一位小数)。
(保留一位小数)。
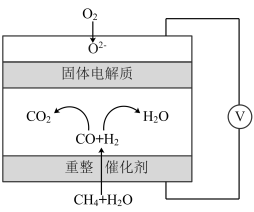
(5)一种高性能甲烷燃料电池的工作原理如图所示。理论上当正极消耗气体的体积为44.8L(标准状况)时,电路中转移的电子数为______  。
。
甲烷水蒸气催化重整发生如下反应:
反应i.

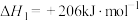
反应ⅱ.


(1)已知反应ⅱ中相关的化学键键能数据如下:
化学键 | H―H | H―O | C―H | C=O |
E/( | 436 | 465 | 413 | 745 |

 。
。(2)为了提高反应中甲烷的平衡转化率,理论上可采取的措施是______。
| A.恒容时通入氮气 | B.升高温度 | C.及时分离氢气 | D.选择合适的催化剂 |
(3)把甲烷和水蒸气按物质的量之比1∶3通入反应器中,其他条件不变,在不同温度下探究CaO对平衡时干燥出口气中
 物质的量分数的影响,结果如下:
物质的量分数的影响,结果如下: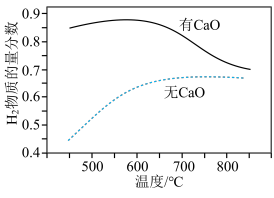
②在400~600℃范围内,反应器中有CaO能大幅提高
 物质的量分数,原因是
物质的量分数,原因是(4)某温度下,在体积为1L的容器中加入1mol
 、3mol水蒸气进行催化重整反应,达到平衡时
、3mol水蒸气进行催化重整反应,达到平衡时 的总转化率为80%,CO的浓度为
的总转化率为80%,CO的浓度为 。
。 的平衡浓度为
的平衡浓度为 ,反应i的平衡常数为
,反应i的平衡常数为 (保留一位小数)。
(保留一位小数)。(5)一种高性能甲烷燃料电池的工作原理如图所示。理论上当正极消耗气体的体积为44.8L(标准状况)时,电路中转移的电子数为
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是___________ 。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)___________ 184.4kJ。
③已知:

1 mol N-H键断裂吸收的能量等于___________ kJ。
④理论上,为了增大平衡时H2的转化率,可采取的措施是___________ (填序号)。
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
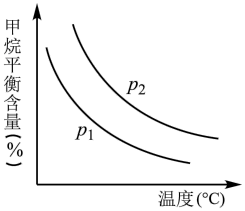
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的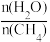 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示。则图中两条曲线表示的压强的关系是:p1
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示。则图中两条曲线表示的压强的关系是:p1___________ p2(填“>”“=”或“<”)。
(3)原料气H2还可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为___________ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是___________ (填序号)。
a. 混合气体的平均相对分子质量不随时间改变
b. 混合气体的密度不随时间改变
c. 单位时间内生成a mol CO2的同时消耗a mol H2
d. 混合气中n(CO) :n(H2O) :n(CO2) :n(H2)=1 :16 :6 :6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
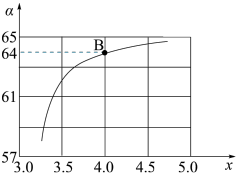
在一定温度和压强下,若原料气中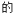 NH3和CO2的物质的量之比(氨碳比)
NH3和CO2的物质的量之比(氨碳比)  =x,下图是氨碳比(x)与CO2平衡转化率(
=x,下图是氨碳比(x)与CO2平衡转化率( :%)的关系。下图中的B点处,NH3的平衡转化率为
:%)的关系。下图中的B点处,NH3的平衡转化率为___________ 。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)
③已知:

1 mol N-H键断裂吸收的能量等于
④理论上,为了增大平衡时H2的转化率,可采取的措施是
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的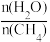 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示。则图中两条曲线表示的压强的关系是:p1
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示。则图中两条曲线表示的压强的关系是:p1
(3)原料气H2还可通过反应CO(g)+H2O(g)
 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。①T℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a. 混合气体的平均相对分子质量不随时间改变
b. 混合气体的密度不随时间改变
c. 单位时间内生成a mol CO2的同时消耗a mol H2
d. 混合气中n(CO) :n(H2O) :n(CO2) :n(H2)=1 :16 :6 :6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
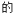 NH3和CO2的物质的量之比(氨碳比)
NH3和CO2的物质的量之比(氨碳比)  =x,下图是氨碳比(x)与CO2平衡转化率(
=x,下图是氨碳比(x)与CO2平衡转化率( :%)的关系。下图中的B点处,NH3的平衡转化率为
:%)的关系。下图中的B点处,NH3的平衡转化率为
您最近一年使用:0次



