氮、磷、砷等元素的单质及其化合物在生产生活中应用广泛。回答下列问题:
(1) 是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用,
是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用, 分子的空间构型为
分子的空间构型为________ 。
(2)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于__________ 晶体。
(3)石墨相氮化碳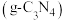 作为一种新型光催化材料,研究表明,非金属掺杂(
作为一种新型光催化材料,研究表明,非金属掺杂( 等)能提高其光催化活性。
等)能提高其光催化活性。 具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法
具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法不正确 的是 。
(4) 是一种重要的半导体材料,晶胞结构如图1;将
是一种重要的半导体材料,晶胞结构如图1;将 掺杂到
掺杂到 的晶体中得到稀磁性半导体材料,如图2。
的晶体中得到稀磁性半导体材料,如图2。 ,则B原子的分数坐标为
,则B原子的分数坐标为_______ ;若 晶体密度为
晶体密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个
为阿伏加德罗常数的值,则晶胞中两个 原子间的最小距离为
原子间的最小距离为_________  (列出计算式即可);稀磁性半导体材料中
(列出计算式即可);稀磁性半导体材料中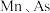 的原子个数比为
的原子个数比为_________ 。
(1)
 是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用,
是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用, 分子的空间构型为
分子的空间构型为(2)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(3)石墨相氮化碳
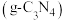 作为一种新型光催化材料,研究表明,非金属掺杂(
作为一种新型光催化材料,研究表明,非金属掺杂( 等)能提高其光催化活性。
等)能提高其光催化活性。 具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法
具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法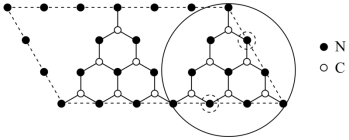
| A.基态C原子的成对电子数与未成对电子数之比为2∶1 |
B.1mol  晶体中含有C-N键的数目为4.5NA 晶体中含有C-N键的数目为4.5NA |
C. 原子的配位数为2和3 原子的配位数为2和3 |
D. 晶体中存在的微粒间作用力有共价键和范德华力 晶体中存在的微粒间作用力有共价键和范德华力 |
 是一种重要的半导体材料,晶胞结构如图1;将
是一种重要的半导体材料,晶胞结构如图1;将 掺杂到
掺杂到 的晶体中得到稀磁性半导体材料,如图2。
的晶体中得到稀磁性半导体材料,如图2。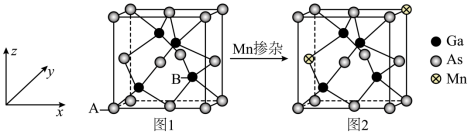
 ,则B原子的分数坐标为
,则B原子的分数坐标为 晶体密度为
晶体密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个
为阿伏加德罗常数的值,则晶胞中两个 原子间的最小距离为
原子间的最小距离为 (列出计算式即可);稀磁性半导体材料中
(列出计算式即可);稀磁性半导体材料中 的原子个数比为
的原子个数比为
更新时间:2024-05-08 16:28:56
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】6月17日,我国第三艘航空母舰命名为“中国人民解放军海军福建舰”,舷号为“18”。航母的甲板用钢具有高强度、大板面、拒磁、高韧性、抗低温(零下38°C)等特性。
(1)铁中掺入铬,铬含量在10.5%以上,它的耐腐蚀性能显著增加。基态铬原子的价电子排布式为_______ ,基态铁原子核外有_______ 个电子云伸展方向。
(2)硅油是一种不同聚合度链状结构的聚有机硅氧烷。它具有耐热性、电绝缘性、耐候性等优点,因此可用于保护甲板,其结构简式如图所示。

硅油中碳原子的杂化方式为_______ 杂化,O−Si的键能比C−Si的_______ (填“大”或“小”),其原因是_______ 。
(3)铁的常见的两种氧化物为FeO、 ,FeO的熔点比
,FeO的熔点比 的
的_______ (填“高”或“低”),其原因是_______ 。
(4)铁粉在高温氮氛围下能够形成强磁性铁氮化合物,其晶胞结构如图所示,则该铁氮化合物的化学式为_______ ,设晶胞密度为ρg∙cm−3, 为阿伏加德罗常数的值,则该晶胞中氮原子到顶点铁原子之间的距离为
为阿伏加德罗常数的值,则该晶胞中氮原子到顶点铁原子之间的距离为_______ cm(用代数式表示)。

(1)铁中掺入铬,铬含量在10.5%以上,它的耐腐蚀性能显著增加。基态铬原子的价电子排布式为
(2)硅油是一种不同聚合度链状结构的聚有机硅氧烷。它具有耐热性、电绝缘性、耐候性等优点,因此可用于保护甲板,其结构简式如图所示。

硅油中碳原子的杂化方式为
(3)铁的常见的两种氧化物为FeO、
 ,FeO的熔点比
,FeO的熔点比 的
的(4)铁粉在高温氮氛围下能够形成强磁性铁氮化合物,其晶胞结构如图所示,则该铁氮化合物的化学式为
 为阿伏加德罗常数的值,则该晶胞中氮原子到顶点铁原子之间的距离为
为阿伏加德罗常数的值,则该晶胞中氮原子到顶点铁原子之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC中化学键为离子键,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且B、C氢化物的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________________ 。
(2)B的氢化物的分子立体构型是________________ ,中心原子的杂化类型是_______ 。
(3)写出化合物AC2的电子式_______________ 。
(4)E的基态原子核外电子排布式是_________________ ,ECl3形成的配合物的化学式为________ 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是___________________ 。
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子立体构型是
(3)写出化合物AC2的电子式
(4)E的基态原子核外电子排布式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】化学·选修3:物质结构与性质
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石( Na3AlF6)等。回答下列问题:
(1)基态氟原子中有_________________ 种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3( -33° C)的沸点比NF3( -129° C)的高,原因为_____________ 。
(3)氟硼酸( HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:________ 。
(4)液态[H2F]+中存在[H2F]+和[HF2]- ,[HF2]-的结构可表示为[F-H…F]- ,[H2F]+的VSEPR模型名称为________ 形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160°C分解。NaHF2中所含作用力的类型有______ . (填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(5)CaF2是难溶化合物,其晶胞结构如图所示:
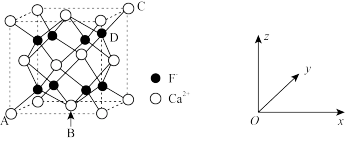
①若原子坐标参数A处为(0,0,0),B处为(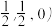 ,C处为(1,1,1),则D处为
,C处为(1,1,1),则D处为_____ .
②每个Ca2+周围距离最近的Ca2+共有_____ 个。
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为____ nm(设NA表示阿伏加 德罗常数的值,用含c、NA的式子表示)。
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石( Na3AlF6)等。回答下列问题:
(1)基态氟原子中有
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3( -33° C)的沸点比NF3( -129° C)的高,原因为
(3)氟硼酸( HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:
(4)液态[H2F]+中存在[H2F]+和[HF2]- ,[HF2]-的结构可表示为[F-H…F]- ,[H2F]+的VSEPR模型名称为
a 离子键 b 共价键 c 配位键 d 氢键
(5)CaF2是难溶化合物,其晶胞结构如图所示:

①若原子坐标参数A处为(0,0,0),B处为(
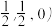 ,C处为(1,1,1),则D处为
,C处为(1,1,1),则D处为②每个Ca2+周围距离最近的Ca2+共有
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
⑴请写出:D基态原子的价层电子排图:______ ;F 基态原子的外围电子排布式: ______ .
⑵下列说法错误的是______ .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为______  用元素符号表示
用元素符号表示 .
.
⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有______ .
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为______ .
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率______ .
⑴请写出:D基态原子的价层电子排图:
⑵下列说法错误的是
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为
 用元素符号表示
用元素符号表示 .
.⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有
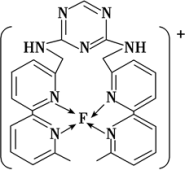
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】根据已学知识,请回答下列问题:
(1)最外层电子排布为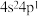 的基态原子的核电荷数为
的基态原子的核电荷数为_______ 。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其基态原子的外围电子排布式为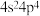 ,该元素的名称是
,该元素的名称是_______
(3)基态Fe原子中,电子填充的能量最高的能级符号为_______ ;基态N原子的轨道表示为_______ 。
(4)已知熔融的 不导电,则
不导电,则 属于
属于_______ 晶体,中心原子的杂化类型为_______ 。
(5)氨水中存在_______ 种氢键,任写其中的一种_______ 。
(6)As的电子排布简式为:[Ar]_______ ;它有两种含氧酸: 和
和 ,其中酸性较强的是
,其中酸性较强的是_______ 。
(7) 的一种配离子
的一种配离子 中,
中, 的配位数是
的配位数是_______ 。配体 中心原子的杂化类型为
中心原子的杂化类型为_______ 。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因_______
(1)最外层电子排布为
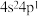 的基态原子的核电荷数为
的基态原子的核电荷数为(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其基态原子的外围电子排布式为
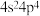 ,该元素的名称是
,该元素的名称是(3)基态Fe原子中,电子填充的能量最高的能级符号为
(4)已知熔融的
 不导电,则
不导电,则 属于
属于(5)氨水中存在
(6)As的电子排布简式为:[Ar]
 和
和 ,其中酸性较强的是
,其中酸性较强的是(7)
 的一种配离子
的一种配离子 中,
中, 的配位数是
的配位数是 中心原子的杂化类型为
中心原子的杂化类型为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
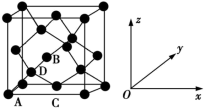
【推荐3】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的电子排布式为_______ ,有_______ 个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因:_______ 。
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(4)原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0);则D原子的坐标参数为
,0);则D原子的坐标参数为_______ 。
(1)基态Ge原子的电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因:
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0);则D原子的坐标参数为
,0);则D原子的坐标参数为
您最近一年使用:0次



