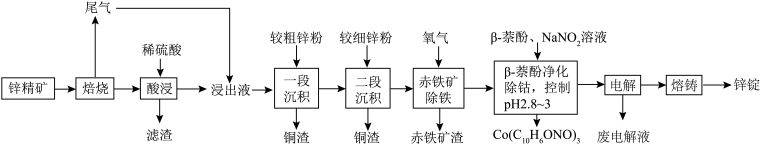
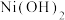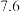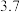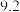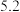湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图:
(1)铜原子的价层电子排布图为_____ 。
(2)“酸浸”中滤渣主要成分为_____ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:_____ 。
(4)“β—萘酚净化除钴”先是NaNO2把Co2+氧化成Co3+,并生成NO,Co3+与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出Co2+被氧化的离子方程式:_____ 。
(5)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。_____ (x和y用具体数字表示)。
②若Li2S的晶胞参数为ann,则EF间的距离为_____ nm。
(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)“β—萘酚净化除钴”先是NaNO2把Co2+氧化成Co3+,并生成NO,Co3+与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出Co2+被氧化的离子方程式:
(5)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
②若Li2S的晶胞参数为ann,则EF间的距离为
更新时间:2024-05-23 09:28:36
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:

(1)试剂Ⅰ一般选用_________ (填化学式)。
(2)工业制取镁的化学方程式为_____________________________________ 。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
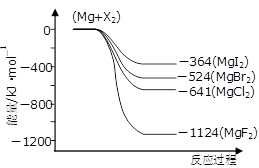
①由图可知Mg与卤素单质的反应均为_________ (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 ______ MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式_________________________ 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式______________ 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因_________ 。

(1)试剂Ⅰ一般选用
(2)工业制取镁的化学方程式为
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

①由图可知Mg与卤素单质的反应均为
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业上常利用软锰矿浆(主要成分是MnO2,还含有硅、铁和少量重金属镍的化合物等杂质)制备MnSO4溶液,并以MnSO4溶液为原料制取单质锰和四氧化三锰。
(1)MnSO4溶液的制备:
①还原:以稀硫酸作介质,纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为______ 。
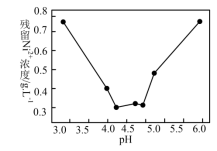
②除杂:除去硅、铁等杂质后,通常用BaS来除去溶液中的镍,pH对除镍效果的影响如图所示。当pH<4.2,pH越小除镍效果越差的原因是_____ 。
(2)电解法制锰:
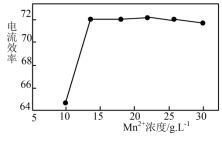
为保证电解顺利进行,电解液中Mn2+必须保持一定的浓度。Mn2+浓度和电流效率(电流效率是指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比)的关系如图所示。由图可知当Mn2+浓度大于22g·L-1时,电流效率随Mn2+浓度增大反而下降,其原因是_____ 。
(3)制取Mn3O4:
利用MnSO4溶液,用空气氧化法制备Mn3O4。在MnSO4溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备Mn3O4。
①写出上述反应的离子方程式:_____ 。
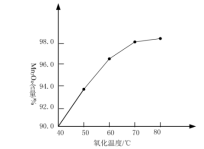
②Mn3O4的含量与反应温度的关系如图所示。随着反应温度的升高,产物中Mn3O4的含量的上升趋势呈现先快后慢的原因是_____ 。
(1)MnSO4溶液的制备:
①还原:以稀硫酸作介质,纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为
②除杂:除去硅、铁等杂质后,通常用BaS来除去溶液中的镍,pH对除镍效果的影响如图所示。当pH<4.2,pH越小除镍效果越差的原因是

(2)电解法制锰:
为保证电解顺利进行,电解液中Mn2+必须保持一定的浓度。Mn2+浓度和电流效率(电流效率是指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比)的关系如图所示。由图可知当Mn2+浓度大于22g·L-1时,电流效率随Mn2+浓度增大反而下降,其原因是

(3)制取Mn3O4:
利用MnSO4溶液,用空气氧化法制备Mn3O4。在MnSO4溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备Mn3O4。
①写出上述反应的离子方程式:
②Mn3O4的含量与反应温度的关系如图所示。随着反应温度的升高,产物中Mn3O4的含量的上升趋势呈现先快后慢的原因是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________ 种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:_______________________ ;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
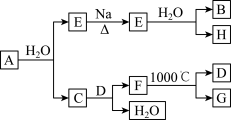
请回答下列问题:
①F的化学式为________ ,D的电子式为________________ 。
②E与水反应的化学方程式为___________________________________________ ;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)_______________________________________________________ 。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
①F的化学式为
②E与水反应的化学方程式为
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____ 区,基态原子价电子排布图为_______ 。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______ 。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为______ , lmol CH2=CH2中含有的σ键数目为______ 。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________ 。
(4) PrO2(二氧化镨)的晶体结构与CaF2相似,晶饱中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________ 个氧原子。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______ ,列式表示Ce(铈)单质的密度:________ g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
(1)钪(Sc)为21号元素,位于周期表的
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为
(4) PrO2(二氧化镨)的晶体结构与CaF2相似,晶饱中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的价电子排布图为______ ;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。

①酞菁钴中三种非金属原子的电负性由大到小的顺序为;______ (用相应的元素符号作答);碳原子的杂化轨道类型为______ ;
②与钴离子通过配位键结合的氮原子的编号是______ ;
(3)CoCl2中结晶水数目不同呈现不同的颜色。

CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用________ ;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:________ ;
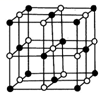
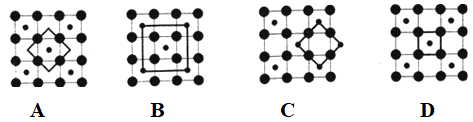
(5)Co的一种氧化物的晶胞如右图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________ 个;筑波材料科学国家实验室的一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是________ 。
(1)Co基态原子的价电子排布图为
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。

①酞菁钴中三种非金属原子的电负性由大到小的顺序为;
②与钴离子通过配位键结合的氮原子的编号是
(3)CoCl2中结晶水数目不同呈现不同的颜色。

CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:
(5)Co的一种氧化物的晶胞如右图所示,在该晶体中与一个钴原子等距离且最近的钴原子有


您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)E位于第_______ 族、_______ 区,该元素原子的核外电子排布式_______ 。
(2)B元素基态原子中能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为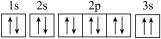 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_______ 。
(4)已知BA5为离子化合物,写出其电子式:_______ 。
(5)检验D元素的方法是_______ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素的第一至第四电离能如下:I1=738kJ·mol-1、I2=1451kJ·mol-1、I3=7733kJ·mol-1、I4=10540kJ·mol-1 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第七列 |
(2)B元素基态原子中能量最高的电子的电子云在空间有
(3)某同学根据上述信息,推断C基态原子的电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)已知BA5为离子化合物,写出其电子式:
(5)检验D元素的方法是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_______ ,第一电离能最小的元素是_______ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是_______ (填化学式),呈现如此递变规律的原因是_______ 。
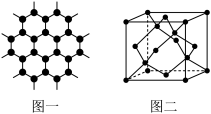
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为_______ 、另一种的晶胞如图二所示,该晶胞的空间利用率为_______ ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为_______  (保留两位有效数字)。(
(保留两位有效数字)。(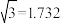 )
)
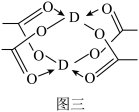
(4)D元素形成的单质,其晶体的堆积模型为_______ ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是_______ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是_______ 。请写出上述过程的离子方程式:_______ 。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
 (保留两位有效数字)。(
(保留两位有效数字)。(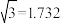 )
)
(4)D元素形成的单质,其晶体的堆积模型为

①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】技术人员制工程蓝图时,是用K3Fe(C2O4)3·3H2O(三草酸合铁酸钾)作感光剂,再以K3Fe(CN)6(六氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)K3Fe(CN)6是检验Fe2+的特征试剂,写出Fe2+的价电子排布图______ 。
(2)在组成上述两种钾盐的元素中第一电离能最大的元素为______ 。
(3)H2C2O4分子中碳原子的杂化类型是______ ;与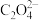 互为等电子体分子的化学式为
互为等电子体分子的化学式为______ 。
(4)六氰合铁酸钾常温下很稳定,经灼烧可完全分解,产生剧毒的氰化钾和氰:2K3Fe(CN)6 6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为
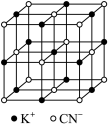
6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为______ 。若KCN的晶胞结构如图所示,则KCN晶体中距离K+最近的K+的数目为______ 。
(1)K3Fe(CN)6是检验Fe2+的特征试剂,写出Fe2+的价电子排布图
(2)在组成上述两种钾盐的元素中第一电离能最大的元素为
(3)H2C2O4分子中碳原子的杂化类型是
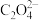 互为等电子体分子的化学式为
互为等电子体分子的化学式为(4)六氰合铁酸钾常温下很稳定,经灼烧可完全分解,产生剧毒的氰化钾和氰:2K3Fe(CN)6
 6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为
6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有__ 种,这些电子的电子云形状有__ 种;氟原子的外围电子排布式为______ .
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有_____ ;与HF2-互为等电子体的分子有___ (举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为____ .
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于__ 晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555nm.
①Ca2+、F-的配位数分别为__ 和__ .
②列式表示氟化钙晶体的密度:_________ g•cm-3(不必计算出结果).

(1)基态氟原子核外电子的运动状态有
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555nm.
①Ca2+、F-的配位数分别为
②列式表示氟化钙晶体的密度:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为 ,含有一定量的
,含有一定量的 、
、 、
、 、
、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的流程如下:
)的流程如下:
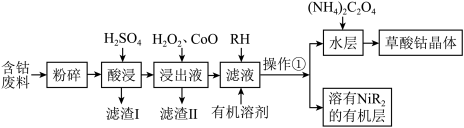
已知:①草酸钴晶体难溶于水。
② 为有机物(难电离)、
为有机物(难电离)、 代表金属离子,
代表金属离子, 。
。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
④滤液中 元素以
元素以 形式存在。
形式存在。
回答下列问题:
(1) 是常用的氧化剂,
是常用的氧化剂, 的电子式为
的电子式为______ 。
(2)“浸出液”中加入 后发生反应的离子方程式为
后发生反应的离子方程式为______ 。
(3)加入氧化钴调节溶液的 ,调节的
,调节的 范围是
范围是______ ,滤渣Ⅱ的主要成分是______ 。
(4)操作①在实验室所用的仪器为____________ 。
(5)可向操作①后溶有 的有机层中加入
的有机层中加入______ (反萃取剂)使 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。
(6)若先将 转化为
转化为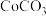 ,再利用反应
,再利用反应 ,却不能实现
,却不能实现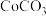 转化为
转化为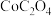 ,请说明理由:
,请说明理由:____________ 。[ ,
, ]
]
 ,含有一定量的
,含有一定量的 、
、 、
、 、
、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的流程如下:
)的流程如下:
已知:①草酸钴晶体难溶于水。
②
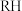 为有机物(难电离)、
为有机物(难电离)、 代表金属离子,
代表金属离子, 。
。③流程中部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:沉淀物 |
|
|
|
|
|
开始沉淀 |
|
|
|
|
|
完全沉淀 |
|
|
|
|
|
 元素以
元素以 形式存在。
形式存在。回答下列问题:
(1)
 是常用的氧化剂,
是常用的氧化剂, 的电子式为
的电子式为(2)“浸出液”中加入
 后发生反应的离子方程式为
后发生反应的离子方程式为(3)加入氧化钴调节溶液的
 ,调节的
,调节的 范围是
范围是(4)操作①在实验室所用的仪器为
(5)可向操作①后溶有
 的有机层中加入
的有机层中加入 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。(6)若先将
 转化为
转化为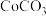 ,再利用反应
,再利用反应 ,却不能实现
,却不能实现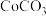 转化为
转化为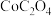 ,请说明理由:
,请说明理由: ,
, ]
]
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:
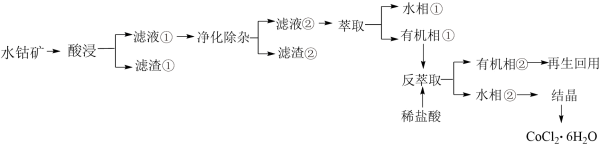
回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________ 、_________ ;滤渣①的主要成分为__________ 。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为______________________________ 。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,离子方程式为____________________________________ 。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____________ mol·L-1(取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________ 。
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________ (写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______ (产率=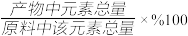 )。
)。

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,离子方程式为
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=
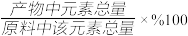 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
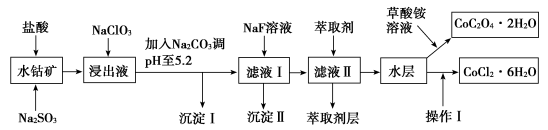
已知:①浸出液中含有的阳离子主要有H+、Na+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③已知氧化性:Co3+>MnO2>ClO >Fe3+
>Fe3+
④流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)得到水钴矿的前一步是对粗矿的粉末“焙烧”,该步氧化数据如表所示:
在对流空气中氧化效率高且氧化时间短的原因是_______ 。
(2)浸出过程中加入Na2SO3作用是_______ 。
(3)NaClO3在浸出液中发生反应的离子方程式为_______ 。
(4)加入Na2CO3调pH至5.2,目的是_______ ;萃取剂层含锰元素,则加入NaF溶液所得沉淀II的主要成分为_______ 。
(5)操作I包括:向水层加入_______ 调整pH至2~3,蒸发浓缩_______ 、过滤、洗涤、减压烘干等过程。
(6)根据表格中的数据计算Ksp[Co(OH)2]=_____ (假设离子浓度小于等于10-5mol/L视为完全沉淀,已知100.4=2.5)
(7)将草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中 290~320℃温度范围得到剩余的固体物质化学式为Co3O4,同时产生CO2,写出该过程的化学方程式_____ 。

已知:①浸出液中含有的阳离子主要有H+、Na+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③已知氧化性:Co3+>MnO2>ClO
 >Fe3+
>Fe3+④流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
| 空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
| 暴露空气中 | 450~500 | 88 | 14 |
| 对流空气氧化炉中 | 450~500 | 98 | 6 |
(2)浸出过程中加入Na2SO3作用是
(3)NaClO3在浸出液中发生反应的离子方程式为
(4)加入Na2CO3调pH至5.2,目的是
(5)操作I包括:向水层加入
(6)根据表格中的数据计算Ksp[Co(OH)2]=
(7)将草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中 290~320℃温度范围得到剩余的固体物质化学式为Co3O4,同时产生CO2,写出该过程的化学方程式
您最近一年使用:0次