固态化合物M的组成为CuSi2O5,以M为原料实现如下转化:
(1)①固体D的成分为_______ ,溶液E中含氮微粒有_______ 。
②写出反应Ⅱ的化学反应方程式_______ 。
③溶液F加热可得纳米 ,过程中pH会明显下降,原因是
,过程中pH会明显下降,原因是_______ 。
(2)下列说法正确的是_______。
(3)已知 能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验_______ 。
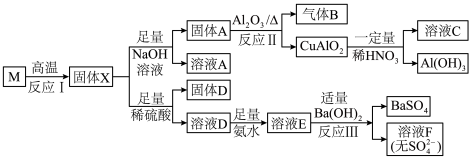
(1)①固体D的成分为
②写出反应Ⅱ的化学反应方程式
③溶液F加热可得纳米
 ,过程中pH会明显下降,原因是
,过程中pH会明显下降,原因是(2)下列说法正确的是_______。
| A.反应Ⅰ不能在陶瓷坩埚中进行 |
| B.固体X可溶于浓氨水 |
| C.溶液A经净化处理后可用于工业粘合剂 |
D.反应Ⅲ中发生的离子反应有: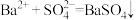 |
(3)已知
 能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
更新时间:2024-06-08 06:58:55
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】铬矿是冶金、国防、化工等领域不可缺少的矿产资源,其中的铬铁矿是唯一可开采的铬矿石。工业上常用铬铁矿(主要含Fe2O3、FeO和Cr2O3,还含有MgO、Al2O3、SiO2等杂质)为原料制备重铬酸钾和三氧化二铁,其流程如图所示。
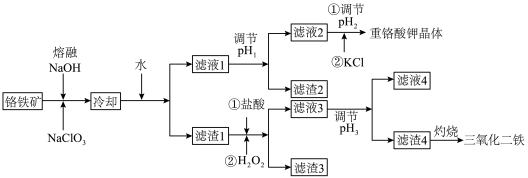
已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。
请回答下列问题:
(1)铬铁矿与熔融 NaOH 和 NaCIO3的反应是在坩埚中进行的,可用作此坩埚材料的是___________ .
A.镍 B.刚玉(Al2O3) C. 陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融 NaOH和NaCIO3反应的化学方程式:___ 。由于在该过程中铁元素会大量转变为NaFeO2,所以加水的作用为__________________ (用离子方程式表示)。
(3)“滤渣 2”的主要成分为_________ (填化学式)。
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是;再向其中加入KC1固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取___________ (填操作名称)。
(5)调节pH3的范围为__________
(6)已知铬铁矿中铁、铬元素的质量比为14:13.上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32t,则可以制备K2Cr2O7的质量为______ t(结果保留1位小数)。

已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。
| Fe3+ | Al3+ | Mg2+ |  | 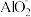 | |
| 开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
| 沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
(1)铬铁矿与熔融 NaOH 和 NaCIO3的反应是在坩埚中进行的,可用作此坩埚材料的是
A.镍 B.刚玉(Al2O3) C. 陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融 NaOH和NaCIO3反应的化学方程式:
(3)“滤渣 2”的主要成分为
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是;再向其中加入KC1固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取
(5)调节pH3的范围为
(6)已知铬铁矿中铁、铬元素的质量比为14:13.上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32t,则可以制备K2Cr2O7的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】镍电池是一类应用比较广泛的可充电电池,报废后其金属外壳可以直接回收,同时芯废料中含有的大量金属元素也可被利用。已知芯废料中镍元素含量在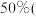 质量分数,下同
质量分数,下同 左右,钴、铝、铁、铬含量为
左右,钴、铝、铁、铬含量为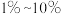 。某课题小组研究废镍电池资源化生产醋酸钴、硫酸镍的工艺流程如下:
。某课题小组研究废镍电池资源化生产醋酸钴、硫酸镍的工艺流程如下:

回答下列问题:
(1)芯废料中的金属元素多以单质形式存在,不宜用浓硫酸浸取。用稀硫酸浸取时,为了提高浸取率,可以采取的措施是__________  任写一条
任写一条 。
。
(2)“氧化除杂”时,先加入 溶液,再调节溶液的pH为
溶液,再调节溶液的pH为 。加入
。加入 的目的是
的目的是_____________  用离子方程式表示
用离子方程式表示 。
。
(3)向除杂后的滤液中加入NaClO溶液,反应后溶液呈酸性, 转化为
转化为 而
而 不发生变化,从而实现钴、镍分离。写出该过程中发生反应的离子方程式:
不发生变化,从而实现钴、镍分离。写出该过程中发生反应的离子方程式:_____ 。
(4)可用CO气体与碱性醋酸钴溶液在一定条件下反应制备催化剂四羰基钴钠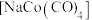 ,反应原理为
,反应原理为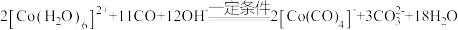 。不同条件下制备四羰基钴钠,然后探究其催化环氧乙烷
。不同条件下制备四羰基钴钠,然后探究其催化环氧乙烷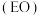 羰基化合成MHP的性能,结果如图所示。
羰基化合成MHP的性能,结果如图所示。
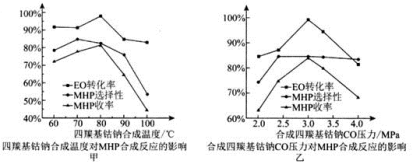
①根据合成四羰基钴钠的反应原理,分析温度 低于
低于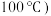 、压强对该反应的反应速率及醋酸钴转化率的影响:
、压强对该反应的反应速率及醋酸钴转化率的影响:__________ 。
②由图甲可知,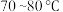 时,温度升高有利于提高
时,温度升高有利于提高________ 。
③由图乙可知,合成四羰基钴钠的最佳压强为_____________ 。
④由图可知,四羰基钴钠催化环氧乙烷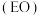 羰基化合成MHP时,当温度高于
羰基化合成MHP时,当温度高于 时,MHP的收率迅速降低的主要原因可能为
时,MHP的收率迅速降低的主要原因可能为___________ ;压强大于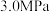 时,MHP的收率迅速降低的主要原因可能为
时,MHP的收率迅速降低的主要原因可能为______ 。
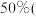 质量分数,下同
质量分数,下同 左右,钴、铝、铁、铬含量为
左右,钴、铝、铁、铬含量为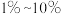 。某课题小组研究废镍电池资源化生产醋酸钴、硫酸镍的工艺流程如下:
。某课题小组研究废镍电池资源化生产醋酸钴、硫酸镍的工艺流程如下:
回答下列问题:
(1)芯废料中的金属元素多以单质形式存在,不宜用浓硫酸浸取。用稀硫酸浸取时,为了提高浸取率,可以采取的措施是
 任写一条
任写一条 。
。(2)“氧化除杂”时,先加入
 溶液,再调节溶液的pH为
溶液,再调节溶液的pH为 。加入
。加入 的目的是
的目的是 用离子方程式表示
用离子方程式表示 。
。(3)向除杂后的滤液中加入NaClO溶液,反应后溶液呈酸性,
 转化为
转化为 而
而 不发生变化,从而实现钴、镍分离。写出该过程中发生反应的离子方程式:
不发生变化,从而实现钴、镍分离。写出该过程中发生反应的离子方程式:(4)可用CO气体与碱性醋酸钴溶液在一定条件下反应制备催化剂四羰基钴钠
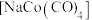 ,反应原理为
,反应原理为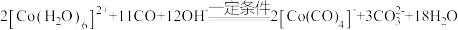 。不同条件下制备四羰基钴钠,然后探究其催化环氧乙烷
。不同条件下制备四羰基钴钠,然后探究其催化环氧乙烷 羰基化合成MHP的性能,结果如图所示。
羰基化合成MHP的性能,结果如图所示。
①根据合成四羰基钴钠的反应原理,分析温度
 低于
低于 、压强对该反应的反应速率及醋酸钴转化率的影响:
、压强对该反应的反应速率及醋酸钴转化率的影响:②由图甲可知,
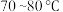 时,温度升高有利于提高
时,温度升高有利于提高③由图乙可知,合成四羰基钴钠的最佳压强为
④由图可知,四羰基钴钠催化环氧乙烷
 羰基化合成MHP时,当温度高于
羰基化合成MHP时,当温度高于 时,MHP的收率迅速降低的主要原因可能为
时,MHP的收率迅速降低的主要原因可能为 时,MHP的收率迅速降低的主要原因可能为
时,MHP的收率迅速降低的主要原因可能为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有___________ (写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、___________ ,“浸出液”调节pH的范围为___________ ,调节pH选用的试剂可以是___________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为___________ 。
(4)向Co(OH)3中加入H2SO4-H2O2混合液,H2O2的作用是___________ 。
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于___________ mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式:___________ {已知:Ksp[Co(OH)2]=2×10-15};
(6)由“母液4”获取NiSO4·7H2O的操作是___________ 、___________ 、过滤、洗涤。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有
(2)沉淀A的主要成分是Fe(OH)3、
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为
(4)向Co(OH)3中加入H2SO4-H2O2混合液,H2O2的作用是
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于
(6)由“母液4”获取NiSO4·7H2O的操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某兴趣小组用硫酸铜制备硫酸四氨合铜( ,
,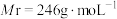 ),并对产品的纯度进行了测定。
),并对产品的纯度进行了测定。
实验一:硫酸四氨合铜的制备

实验二:硫酸四氨合铜纯度测定
步骤①:准确称取mg固体于烧杯中,加稀硫酸溶解,再定容至250mL
步骤②:量取上述试液25.00mL于锥形瓶中,加入100mL水和KI固体(稍过量)
步骤③:用 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用
)滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL。
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL。
已知:① 溶于水。
溶于水。
② ,
, ,CuI沉淀表面易吸附
,CuI沉淀表面易吸附 。
。
③CuSCN比CuI更难溶。
④ 。
。
请回答:
(1)硫酸四氨合铜的制备过程中,步骤Ⅲ中加入95%乙醇能降低溶质溶解度的原因_______ 。
(2)下列说法正确的是_______ 。
A.配制250mL溶液的实验中用到的玻璃仪器只包括烧杯、玻璃棒、250mL容量瓶
B.滴定时,加入KSCN的目的是把CuI吸附的 释放出来
释放出来
C.上述测定过程提及的仪器中容量瓶、锥形瓶,在使用前一定不能润洗
D.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
E.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
(3)硫酸四氨合铜纯度测定过程中:
①Cu2+与I-反应时,pH不能过高,给出两点理由:_______ 。
②滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______ 。
检漏→蒸馏水洗涤→(_______)→(_______)→(_______)→(_______)→(_______)→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液 E.记录起始读数 F.用滴定液润洗2至3次 G.排除气泡
③在横线上补全滴定管润洗的操作:从滴定管上口加入3~5mL所要盛装的酸或碱,_______ 。然后,一手控制活塞(轻轻转动酸式滴定管的活塞:或者轻轻挤压碱式滴定管中的玻璃球),将液体从滴定管下部放入预置的烧杯中。重复2-3次。
④硫酸四氨合铜纯度是_______ (用m、V表示)。
 ,
,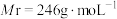 ),并对产品的纯度进行了测定。
),并对产品的纯度进行了测定。实验一:硫酸四氨合铜的制备

实验二:硫酸四氨合铜纯度测定
步骤①:准确称取mg固体于烧杯中,加稀硫酸溶解,再定容至250mL
步骤②:量取上述试液25.00mL于锥形瓶中,加入100mL水和KI固体(稍过量)
步骤③:用
 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用
)滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL。
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL。已知:①
 溶于水。
溶于水。②
 ,
, ,CuI沉淀表面易吸附
,CuI沉淀表面易吸附 。
。③CuSCN比CuI更难溶。
④
 。
。请回答:
(1)硫酸四氨合铜的制备过程中,步骤Ⅲ中加入95%乙醇能降低溶质溶解度的原因
(2)下列说法正确的是
A.配制250mL溶液的实验中用到的玻璃仪器只包括烧杯、玻璃棒、250mL容量瓶
B.滴定时,加入KSCN的目的是把CuI吸附的
 释放出来
释放出来C.上述测定过程提及的仪器中容量瓶、锥形瓶,在使用前一定不能润洗
D.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
E.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
(3)硫酸四氨合铜纯度测定过程中:
①Cu2+与I-反应时,pH不能过高,给出两点理由:
②滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→(_______)→(_______)→(_______)→(_______)→(_______)→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液 E.记录起始读数 F.用滴定液润洗2至3次 G.排除气泡
③在横线上补全滴定管润洗的操作:从滴定管上口加入3~5mL所要盛装的酸或碱,
④硫酸四氨合铜纯度是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】铜氨法可用于测定待测气体中氧气浓度。该法是以Cu作为还原剂,用一定量NH4Cl溶液和氨水的混合液作为吸收液吸收O2,其原理如图所示。

已知:水溶液中[Cu(NH3)4]2+为蓝色,[Cu(NH3)2]+为无色;CuOH为黄色不溶于水的固体。
(1)新制的吸收液(NH4Cl溶液和氨水的混合液)呈碱性,由溶质微粒在水溶液中存在的平衡解释其原因:_____ 。
(2)循环阶段的两步反应为:
i._____ ;
ii.4[Cu(NH3)2]++O2+4NH3+4 =4[Cu(NH3)4]2++2H2O。
=4[Cu(NH3)4]2++2H2O。
(3)若保持常温常压下测得VmL待测气体吸收后剩余气体的体积为V1mL,则待测气体中O2的物质的量分数=_____ 。
(4)如图原理中,启动阶段和循环阶段总反应相同。相比启动阶段,循环阶段反应速率较快的原因是______ 。
(5)配制吸收液时,可在吸收液中加入少量CuSO4溶液,目的是_____ 。
(6)随着吸收过程不断进行,当吸收液中产生黄绿色浑浊[CuOH、Cu(OH)2]时,表明吸收液已失效。产生该现象的原因:随着溶液中NH3被消耗,_____ 。

已知:水溶液中[Cu(NH3)4]2+为蓝色,[Cu(NH3)2]+为无色;CuOH为黄色不溶于水的固体。
(1)新制的吸收液(NH4Cl溶液和氨水的混合液)呈碱性,由溶质微粒在水溶液中存在的平衡解释其原因:
(2)循环阶段的两步反应为:
i.
ii.4[Cu(NH3)2]++O2+4NH3+4
 =4[Cu(NH3)4]2++2H2O。
=4[Cu(NH3)4]2++2H2O。(3)若保持常温常压下测得VmL待测气体吸收后剩余气体的体积为V1mL,则待测气体中O2的物质的量分数=
(4)如图原理中,启动阶段和循环阶段总反应相同。相比启动阶段,循环阶段反应速率较快的原因是
(5)配制吸收液时,可在吸收液中加入少量CuSO4溶液,目的是
(6)随着吸收过程不断进行,当吸收液中产生黄绿色浑浊[CuOH、Cu(OH)2]时,表明吸收液已失效。产生该现象的原因:随着溶液中NH3被消耗,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】无水硫酸铜呈白色,溶于水得蓝色溶液,溶于氨水得深蓝色溶液,这是因为分别形成了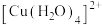 和
和 。某化学实验小组为了探究两种配离子的性质差异,进行如下实验:
。某化学实验小组为了探究两种配离子的性质差异,进行如下实验:
I.向盛有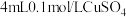 溶液的试管里滴加5滴
溶液的试管里滴加5滴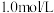 氨水,形成难溶物,继续添加氨水
氨水,形成难溶物,继续添加氨水 ,沉淀溶解并形成深蓝色溶液。
,沉淀溶解并形成深蓝色溶液。
II.向所得深蓝色溶液中加入无水乙醇,有深蓝色晶体析出,将深蓝色晶体过滤、洗涤,取深蓝色晶体溶于水配成溶液a。
III.取一药匙氢氧化铜固体于试管中,加入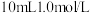 氨水,溶液略变为深蓝色,但沉淀并未见明显溶解。再加入2滴饱和
氨水,溶液略变为深蓝色,但沉淀并未见明显溶解。再加入2滴饱和 溶液,沉淀完全溶解。
溶液,沉淀完全溶解。
IV.取硫酸铜溶液、溶液a分别置于两试管中,向其中各加一枚铁钉, 后观察现象,前者铁钉表面有红色固体析出,后者铁钉无现象。
后观察现象,前者铁钉表面有红色固体析出,后者铁钉无现象。
回答下列问题:
(1)实验I生成难溶物时,反应的离子方程式是___________ ,所得溶液呈深蓝色的原因是溶液中存在___________ 。
(2)实验II深蓝色溶液中析出晶体的原因是___________ 。该深蓝色晶体的化学式为 ,受热时首先失去的组分是
,受热时首先失去的组分是 ,则
,则 与
与 之间以
之间以___________ 结合,晶体中配体与 以
以___________ 结合。
(3)实验沉淀溶解反应的化学方程式是___________ 。加入2滴饱和 溶液为什么能促进沉淀溶解?
溶液为什么能促进沉淀溶解?___________ 。
(4)从实验IV可以得出的结论是___________ 。
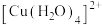 和
和 。某化学实验小组为了探究两种配离子的性质差异,进行如下实验:
。某化学实验小组为了探究两种配离子的性质差异,进行如下实验:I.向盛有
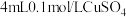 溶液的试管里滴加5滴
溶液的试管里滴加5滴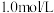 氨水,形成难溶物,继续添加氨水
氨水,形成难溶物,继续添加氨水 ,沉淀溶解并形成深蓝色溶液。
,沉淀溶解并形成深蓝色溶液。II.向所得深蓝色溶液中加入无水乙醇,有深蓝色晶体析出,将深蓝色晶体过滤、洗涤,取深蓝色晶体溶于水配成溶液a。
III.取一药匙氢氧化铜固体于试管中,加入
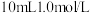 氨水,溶液略变为深蓝色,但沉淀并未见明显溶解。再加入2滴饱和
氨水,溶液略变为深蓝色,但沉淀并未见明显溶解。再加入2滴饱和 溶液,沉淀完全溶解。
溶液,沉淀完全溶解。IV.取硫酸铜溶液、溶液a分别置于两试管中,向其中各加一枚铁钉,
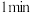 后观察现象,前者铁钉表面有红色固体析出,后者铁钉无现象。
后观察现象,前者铁钉表面有红色固体析出,后者铁钉无现象。回答下列问题:
(1)实验I生成难溶物时,反应的离子方程式是
(2)实验II深蓝色溶液中析出晶体的原因是
 ,受热时首先失去的组分是
,受热时首先失去的组分是 ,则
,则 与
与 之间以
之间以 以
以(3)实验沉淀溶解反应的化学方程式是
 溶液为什么能促进沉淀溶解?
溶液为什么能促进沉淀溶解?(4)从实验IV可以得出的结论是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为____ ;“滤渣A”主要成份的化学式为___ 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + +____ H2O=15Fe2 + + _____ SO42- + ____ 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为____ ;
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_______ (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)_____ 。

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + +
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用_____________
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是__________________ 。

(3)流程中“氧化”步骤主要反应的离子方程式是________________ 。
(4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是_________________ 。
(5)用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度______________ (以mg·L-1为单位)。

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是

(3)流程中“氧化”步骤主要反应的离子方程式是
(4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是
(5)用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】呋喃甲酸 俗名糠酸,可由呋喃甲醛制备,其实验原理和制备步骤如下:
俗名糠酸,可由呋喃甲醛制备,其实验原理和制备步骤如下:
反应1:
反应2:见流程


[实验步骤]向三颈烧瓶中加入16.4 mL(0.2 mol)呋喃甲醛,控制温度在8~12℃下滴加20 mL 40% NaOH溶液,并搅拌回流半小时。向反应混合物中加水使其恰好溶解,加入乙醚分离呋喃甲醇和呋喃甲酸盐,向水层中慢慢滴加浓盐酸至pH为2~3,使呋喃甲酸结晶析出,并通过进一步提纯得到精产品10.0 g。
已知:①无水氯化钙能与醇形成复合物;
②乙醚的沸点是34.5℃,易挥发,遇明火易燃,其蒸气可使人失去知觉:
③呋喃甲酸的溶解度随温度的升高而增大,且升温过程中溶解度变化较大。
回答下列问题:
(1)仪器A的作用是_______ ;步骤②中干燥所使用的干燥剂可选用_______ (填标号)。
A.98%浓硫酸 B.无水氯化钙 C.无水硫酸镁
(2)某同学认为该装置中的磁力搅拌器可以换成沸石,以防暴沸。该说法_______ (填“是”或“否”)正确,其理由是_______ 。
(3)对有机乙醚层进行分离时,用装置B更好的理由有:
Ⅰ.及时排出乙醚,以免对人体造成危害
Ⅱ._______

(4)写出反应原理中反应2的化学方程式_______
(5)进一步提纯粗呋喃甲酸的操作为_______→活性炭脱色→蒸发浓缩→_______→_______→抽滤→洗涤→干燥。_________
(6)呋喃甲酸的产率为_______ (保留3位有效数字)。
 俗名糠酸,可由呋喃甲醛制备,其实验原理和制备步骤如下:
俗名糠酸,可由呋喃甲醛制备,其实验原理和制备步骤如下:反应1:

反应2:见流程


[实验步骤]向三颈烧瓶中加入16.4 mL(0.2 mol)呋喃甲醛,控制温度在8~12℃下滴加20 mL 40% NaOH溶液,并搅拌回流半小时。向反应混合物中加水使其恰好溶解,加入乙醚分离呋喃甲醇和呋喃甲酸盐,向水层中慢慢滴加浓盐酸至pH为2~3,使呋喃甲酸结晶析出,并通过进一步提纯得到精产品10.0 g。
已知:①无水氯化钙能与醇形成复合物;
②乙醚的沸点是34.5℃,易挥发,遇明火易燃,其蒸气可使人失去知觉:
③呋喃甲酸的溶解度随温度的升高而增大,且升温过程中溶解度变化较大。
回答下列问题:
(1)仪器A的作用是
A.98%浓硫酸 B.无水氯化钙 C.无水硫酸镁
(2)某同学认为该装置中的磁力搅拌器可以换成沸石,以防暴沸。该说法
(3)对有机乙醚层进行分离时,用装置B更好的理由有:
Ⅰ.及时排出乙醚,以免对人体造成危害
Ⅱ.

(4)写出反应原理中反应2的化学方程式
(5)进一步提纯粗呋喃甲酸的操作为_______→活性炭脱色→蒸发浓缩→_______→_______→抽滤→洗涤→干燥。
(6)呋喃甲酸的产率为
您最近一年使用:0次



