现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
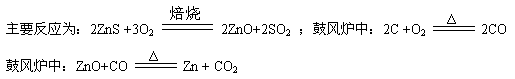
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
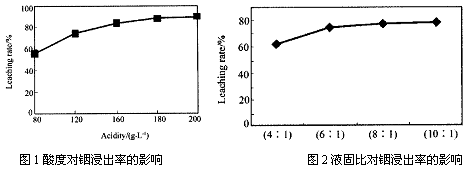
①当酸度为196时,其物质的量浓度为__________ 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______ 、_______ 。
(2)湿法炼锌的主要工艺流程为

①硫酸浸取的主要反应的离子方程式为:___________________________ 。
②从保护环境和充分利用原料角度,如何处理或利用烟气_________________ 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式_______________________ 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知CdO为碱性氧化物,Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式_______________________ 、_____________________ 。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
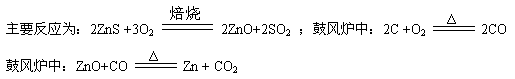
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2

①当酸度为196时,其物质的量浓度为
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:
(2)湿法炼锌的主要工艺流程为

①硫酸浸取的主要反应的离子方程式为:
②从保护环境和充分利用原料角度,如何处理或利用烟气
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知CdO为碱性氧化物,Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式
2010·江苏扬州·模拟预测 查看更多[2]
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
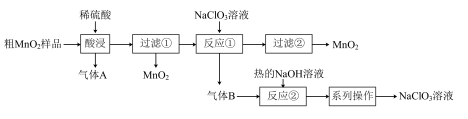
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为___________ 。
(2)反应①的离子方程式为___________ 。
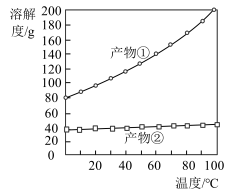
(3)若要得到较浓的 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为___________ (写化学式),“系列操作”为先___________ ,后___________ 。
(4)若粗 样品的质量为
样品的质量为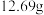 ,经“过滤①”得到
,经“过滤①”得到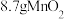 ,并收集到
,并收集到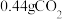 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为___________  。
。
(5)该流程中可循环利用的物质有___________ 。
 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为
(2)反应①的离子方程式为
(3)若要得到较浓的
 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
(4)若粗
 样品的质量为
样品的质量为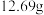 ,经“过滤①”得到
,经“过滤①”得到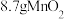 ,并收集到
,并收集到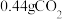 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为 。
。(5)该流程中可循环利用的物质有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下方程式分解:2Mg5Al3(OH)19(H2O)4 27H2O+10MgO+3Al2O3
27H2O+10MgO+3Al2O3
(1)写出Al在周期表中的位置_______ ,铝、镁、氧三种元素的离子半径由大到小的顺序为_______ (填写离子符号)。
(2)该化合物作阻燃剂的两条依据是_______ 、_______ 。
(3)写出Al2O3中阴离子的电子式_______ ,用离子方程式表示除去固体产物中Al2O3的原理_______ 。
(4)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理_______ 。
(5)在25℃、101kPa下,已知12g的Mg在O2中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是_______ 。
 27H2O+10MgO+3Al2O3
27H2O+10MgO+3Al2O3(1)写出Al在周期表中的位置
(2)该化合物作阻燃剂的两条依据是
(3)写出Al2O3中阴离子的电子式
(4)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理
(5)在25℃、101kPa下,已知12g的Mg在O2中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】锰酸锂(LiMn2O4)是锂电池的正极材料,以软锰矿为原料,生产锰酸锂的流程如下:
①软锰矿的成分如下:
②K2MnO4在强碱性溶液(pH大于13.5)中稳定,在酸性、中性和弱碱性环境中会发生歧化反应生成 和MnO2。
和MnO2。
③苯胺(C6H5NH2)还原性较强,在该条件下可被氧化为硝基苯(C6H5NO2)。
④锰酸锂为灰黑色粉末,离子化合物,易溶于水,难溶于无水乙醇。
(1)“氧压浸出”的浸出温度为260°C,并维持500r/min的速率搅拌,此时发生的氧化还原反应的化学方程式为___________ 。
(2)“加热溶解”和“除杂”时均要严格控制溶液pH的原因是___________ ,“除杂”中加入CaO后,需要适当加热并搅拌的目的是___________ ,若此时溶液中c( )=2.5mol/L,则1m3溶液中理论上需要加入的CaO的质量为
)=2.5mol/L,则1m3溶液中理论上需要加入的CaO的质量为___________ kg。
(3)“一系列的操作”是将所得溶液加热浓缩、冷却结晶、过滤、洗涤、干燥,其中洗涤的试剂最好选用___________。
(4)纯度的测定:取0.5800g锰酸锂[Mr(LiMn2O4)=181]样品与稀硝酸和双氧水反应,将Mn元素完全转化为Mn2+,除去过量的双氧水,调节pH,滴加指示剂,用浓度为0.3000mol/L的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(Mn2+与EDTA反应的化学计量数之比为1:1)
①若反应时,N元素的化合价不变,则锰酸锂与稀硝酸和双氧水反应的离子方程式为___________ 。
②样品中锰酸锂的纯度为___________ %(保留两位有效数字)。

①软锰矿的成分如下:
| 成分 | MnO2 | Fe2O3 | CaO | SiO2 | 其他不反应杂质 |
| 质量分数 | 69.6% | 7.6% | 5.6% | 9.0% | 8.2% |
 和MnO2。
和MnO2。③苯胺(C6H5NH2)还原性较强,在该条件下可被氧化为硝基苯(C6H5NO2)。
④锰酸锂为灰黑色粉末,离子化合物,易溶于水,难溶于无水乙醇。
(1)“氧压浸出”的浸出温度为260°C,并维持500r/min的速率搅拌,此时发生的氧化还原反应的化学方程式为
(2)“加热溶解”和“除杂”时均要严格控制溶液pH的原因是
 )=2.5mol/L,则1m3溶液中理论上需要加入的CaO的质量为
)=2.5mol/L,则1m3溶液中理论上需要加入的CaO的质量为(3)“一系列的操作”是将所得溶液加热浓缩、冷却结晶、过滤、洗涤、干燥,其中洗涤的试剂最好选用___________。
| A.冷水 | B.热水 | C.95%的乙醇溶液 | D.LiOH溶液 |
①若反应时,N元素的化合价不变,则锰酸锂与稀硝酸和双氧水反应的离子方程式为
②样品中锰酸锂的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
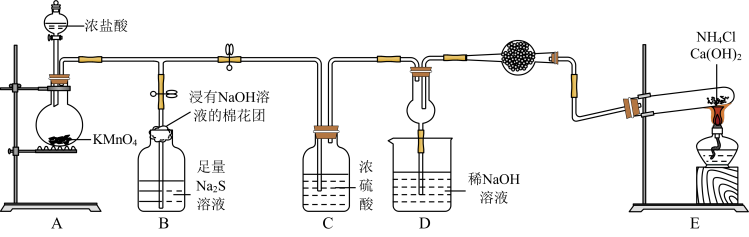
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】重铬酸钠是一种重要的氧化剂,工业上以铬铁矿为主要原料(还含有少量的Al2O3)制取重铬酸钠晶体(Na2Cr2O7·2H2O)流程如图所示。

回答下列问题:
(1)铬铁矿的主要成分为Fe(CrO2)2(名称为亚铬酸亚铁),该物质中铬的化合价是________ ,写出Fe2O3的一种用途______________________ 。
(2)调节pH时要控制好硫酸的用量,理由是_________________________ ,若操作I为蒸发结晶、过滤,则母液所含盐的化学式为________________________ 。
(3)煅烧氧化阶段发生多个反应,写出铬铁矿发生氧化还原反反应的化学方程式__________________________ ,用离子方程式表示目标产物形成的原理:_____________________________ 。
(4)常温下,调节溶液pH=a时,Al3+沉淀完全,则Al(OH)3的Ksp=_____________ (沉淀完全时Al3+的浓度为10-5 mol·L-1)。

回答下列问题:
(1)铬铁矿的主要成分为Fe(CrO2)2(名称为亚铬酸亚铁),该物质中铬的化合价是
(2)调节pH时要控制好硫酸的用量,理由是
(3)煅烧氧化阶段发生多个反应,写出铬铁矿发生氧化还原反反应的化学方程式
(4)常温下,调节溶液pH=a时,Al3+沉淀完全,则Al(OH)3的Ksp=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氧化石墨烯/四氧化三铁(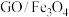 )在吸附材料、磁性材料、电池材料等方面具有广泛的应用前景。某实验小组按如下流程制备
)在吸附材料、磁性材料、电池材料等方面具有广泛的应用前景。某实验小组按如下流程制备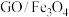 ,并研究其对模拟废水中
,并研究其对模拟废水中 的吸附去除性能。
的吸附去除性能。
Ⅰ:制备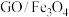

已知:①反应I部分机理:浓硫酸是强质子酸, 嵌入石墨层间破坏范德华力,有助于石墨烯层被剥离开。
嵌入石墨层间破坏范德华力,有助于石墨烯层被剥离开。
②氧化石墨烯是一种单层二维材料,结构中有羧基、羟基和环氧基。
请回答:
(1)实验室研磨用的仪器是_____。
(2)下列有关说法不正确的是_____。
(3)沉淀Ⅱ中的离子方程式_____ 。
(4)反应Ⅰ采用冰水浴,控温的理由是_____ 。
Ⅱ:研究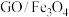 对模拟废水中的吸附去除性能。
对模拟废水中的吸附去除性能。
步骤一:
①配制不同浓度的标准液;
②测定吸光度。分别取0.50mL不同浓度标准液加入一定量酸酸化、摇匀,再加入一定量显色剂,摇匀,用紫外分光光度计在540nm处测量其吸光度;
③根据测定的吸光度值和标准液浓度,绘制吸光度(A)与浓度(c)的标准曲线(如图所示)。

步骤二:
①取10.00mL模拟废水稀释至250mL,用步骤一中②的方法,测得吸光度值为0.6;
②取50.00mL模拟废水,加入进行吸附性能测试,用磁铁分离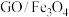 ,用步骤一中②的方法,测得吸光度值为0.6;
,用步骤一中②的方法,测得吸光度值为0.6;
(5)步骤一中,酸化后, 的主要存在的离子形式是
的主要存在的离子形式是_____ ,加入 后
后 的去除率为
的去除率为_____ 。
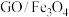 )在吸附材料、磁性材料、电池材料等方面具有广泛的应用前景。某实验小组按如下流程制备
)在吸附材料、磁性材料、电池材料等方面具有广泛的应用前景。某实验小组按如下流程制备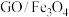 ,并研究其对模拟废水中
,并研究其对模拟废水中 的吸附去除性能。
的吸附去除性能。Ⅰ:制备
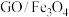

已知:①反应I部分机理:浓硫酸是强质子酸,
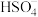 嵌入石墨层间破坏范德华力,有助于石墨烯层被剥离开。
嵌入石墨层间破坏范德华力,有助于石墨烯层被剥离开。②氧化石墨烯是一种单层二维材料,结构中有羧基、羟基和环氧基。
请回答:
(1)实验室研磨用的仪器是_____。
A. | B. | C. | D. |
(2)下列有关说法不正确的是_____。
| A.采用磁力搅拌可减少沉淀Ⅱ中的团聚现象 |
B.取沉淀Ⅱ的上清液,滴入酸性 溶液,褪色说明沉淀II反应未完全 溶液,褪色说明沉淀II反应未完全 |
C.制备GO过程中, 和 和 作氧化剂 作氧化剂 |
| D.反应Ⅰ中,宜将石墨研成细粉,主要目的是增大石墨粒子表面积,提高氧化程度 |
(3)沉淀Ⅱ中的离子方程式
(4)反应Ⅰ采用冰水浴,控温的理由是
Ⅱ:研究
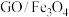 对模拟废水中的吸附去除性能。
对模拟废水中的吸附去除性能。步骤一:
①配制不同浓度的标准液;
②测定吸光度。分别取0.50mL不同浓度标准液加入一定量酸酸化、摇匀,再加入一定量显色剂,摇匀,用紫外分光光度计在540nm处测量其吸光度;
③根据测定的吸光度值和标准液浓度,绘制吸光度(A)与浓度(c)的标准曲线(如图所示)。

步骤二:
①取10.00mL模拟废水稀释至250mL,用步骤一中②的方法,测得吸光度值为0.6;
②取50.00mL模拟废水,加入进行吸附性能测试,用磁铁分离
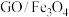 ,用步骤一中②的方法,测得吸光度值为0.6;
,用步骤一中②的方法,测得吸光度值为0.6;(5)步骤一中,酸化后,
 的主要存在的离子形式是
的主要存在的离子形式是 后
后 的去除率为
的去除率为
您最近一年使用:0次
【推荐1】五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
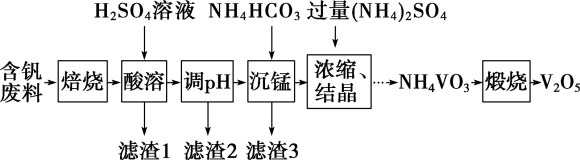
已知Ⅰ.25℃时,难溶电解质的溶度积常数如表所示:
Ⅱ.NH4VO3在水中的溶解度:20℃、4.8 ;60℃、24.2
;60℃、24.2 。
。
回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)“滤渣1”的用途为___________ (写出一种即可)。
(3)滤渣2成分为___________ 。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全___________ 。(溶液中离子浓度小于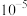
 时,认为该离子沉淀完全)
时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为___________ 。
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式___________ 。
(6) V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:___________ 、___________ 。

已知Ⅰ.25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 |  |  |  |
| Ksp | 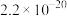 | 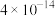 |  |
 ;60℃、24.2
;60℃、24.2 。
。回答下列问题:
(1)“焙烧”的目的是
(2)“滤渣1”的用途为
(3)滤渣2成分为
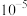
 时,认为该离子沉淀完全)
时,认为该离子沉淀完全)(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式
(6) V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】Pb位于元素周期表第六周期第IVA族,其化合物广泛运用于电池工业、机械制造、特殊玻璃等。某化工厂原以生产PbCO3、PbS为主。现利用废弃铅料,主要成分为PbO2和PbO(PbO溶于稀硝酸),含少量Fe2O3,联合生产三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)和PbO2,设计路线如下:

回答下列问题:
(1)加稀硝酸溶液之前,将废弃铅料在球磨机中磨成粉末,目的是___________
(2)加CS2的目的是溶解固体中的___________ (填化学式),加PbS发生的化学反应方程式为___________
(3)滤液加PbCO3的作用是___________ ,有人提出达到预期的pH后,应小火煮沸一段时间,再过滤,这样做的目的是___________
(4)制备三盐基硫酸铅时,将n(PbSO4):n(NaOH)=4:6配比制成浆糊状,在室温下搅拌60min制得,其产品纯度的影响因素很多,其中反应终点pH对产品中PbO和SO3含量的影响如下图(将PbSO4看作是PbO和SO3,经测定三盐基硫酸铅中PbO理论含量90.10%、SO3理论含量8.08%):

则反应终点控制pH的范围是___________(填序号)。
(5)PbO转化为PbO2发生的离子反应方程式为___________
(6)若akg废料最终制备得到bkg三盐基硫酸铅和ckgPbO2,假设加入的PbCO3刚好抵消流程中损耗的铅元素,则原废料中铅元素的含量为___________ (用含a、b、c的代数式表示)。

回答下列问题:
(1)加稀硝酸溶液之前,将废弃铅料在球磨机中磨成粉末,目的是
(2)加CS2的目的是溶解固体中的
(3)滤液加PbCO3的作用是
(4)制备三盐基硫酸铅时,将n(PbSO4):n(NaOH)=4:6配比制成浆糊状,在室温下搅拌60min制得,其产品纯度的影响因素很多,其中反应终点pH对产品中PbO和SO3含量的影响如下图(将PbSO4看作是PbO和SO3,经测定三盐基硫酸铅中PbO理论含量90.10%、SO3理论含量8.08%):

则反应终点控制pH的范围是___________(填序号)。
| A.<8.4 | B.8.4~8.8 | C.8.8~9.2 | D.>9.2 |
(6)若akg废料最终制备得到bkg三盐基硫酸铅和ckgPbO2,假设加入的PbCO3刚好抵消流程中损耗的铅元素,则原废料中铅元素的含量为
您最近一年使用:0次
【推荐3】磷酸亚铁锂是一种新型锂离子电池电极材料。其特点是放电容量大,价格低廉,无毒性,不造成环境污染。世界各国正竞相实现产业化生产,是目前使用最多的动力电池材料。一种从废旧磷酸亚铁锂正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中回收锂的工艺流程如下:

回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是___________(填字母标号)。
(2)“碱浸”时主要发生的离子方程式为___________ 。
(3)“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为___________ 。“滤渣II”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得LiFePO4,实现再生利用,其化学方程式为___________ 。
(4)“沉锂”的温度保持在90°C,最适宜的加热方式为___________ 。“一系列操作”具体包括___________ 、洗涤、干燥。若所得浸出液中c(Li+)=2.0mol·L-1,“沉锂”结束时溶液中c( )为2.1mol·L-1,则“沉锂”过程中,锂的沉降率为
)为2.1mol·L-1,则“沉锂”过程中,锂的沉降率为___________ %[已知:浸出液在沉锂过程中溶液体积不变,Ksp(Li2CO3)=8.4×10-4]。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取2.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.2000mol•L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,平均消耗重铬酸钾溶液15.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl +Hg2Cl2
+Hg2Cl2
6Fe2++ +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是___________ 。
②磷酸亚铁锂电池中铁的含量为___________ %。

回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是___________(填字母标号)。
| A.适当提高浸出温度 | B.使用电动搅拌器 |
| C.适当提高氢氧化钠的浓度 | D.增大矿石的粒度 |
(3)“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为
(4)“沉锂”的温度保持在90°C,最适宜的加热方式为
 )为2.1mol·L-1,则“沉锂”过程中,锂的沉降率为
)为2.1mol·L-1,则“沉锂”过程中,锂的沉降率为(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取2.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.2000mol•L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,平均消耗重铬酸钾溶液15.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl
 +2Fe2+
+2Fe2+4Cl-+Sn2++2HgCl2=SnCl
 +Hg2Cl2
+Hg2Cl26Fe2++
 +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O①实验中加入HgCl2饱和溶液的目的是
②磷酸亚铁锂电池中铁的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。

(1)海水淡化的方法有_________________ 、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是_________________ mol。
(3)海水中部分离子的含量如下:
其中,Mg2+的物质的量浓度是____________ mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是_______________ g。
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是________________ (填序号)。
A. Mg(OH)2 MgO
MgO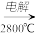 Mg
Mg
B. Mg(OH)2 MgO
MgO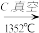 Mg
Mg
C. Mg(OH)2 无水MgCl2
无水MgCl2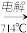 Mg
Mg
D. Mg(OH)2 MgCl2溶液
MgCl2溶液 Mg
Mg

(1)海水淡化的方法有
(2)用纯碱吸收浓缩海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是
(3)海水中部分离子的含量如下:
| 成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
| Na+ | 10560 | Cl- | 18980 |
| Mg2+ | 1272 | Br- | 64 |
| Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是
A. Mg(OH)2
 MgO
MgO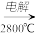 Mg
MgB. Mg(OH)2
 MgO
MgO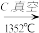 Mg
MgC. Mg(OH)2
 无水MgCl2
无水MgCl2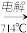 Mg
MgD. Mg(OH)2
 MgCl2溶液
MgCl2溶液 Mg
Mg
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)在此元素周期表的一部分中,金属性最强的元素是__________ (填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为_______ (填元素符号)。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (填化学式)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________ 。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________ 。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为______________ ,N→⑥的单质的化学方程式为______________________ 。

(1)在此元素周期表的一部分中,金属性最强的元素是
(2)⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】在一定条件下可实现下图所示物质之间的转化:
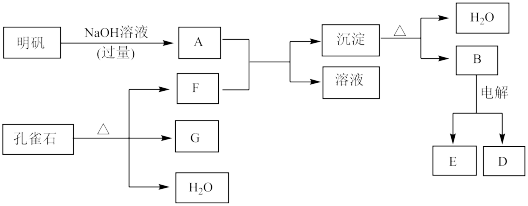
注意:①明矾(KAl(SO4)2·12H2O),可以电离出K+,Al3+,SO
②G是黑色固体,D是金属单质,E是常见的双原子气体分子
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是___________ (填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:___________ 。
(3)写出B电解生成E和D的反应方程式:___________ 。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式___________ ,该反应消耗了2 molG,则转移的电子数是___________ 。

注意:①明矾(KAl(SO4)2·12H2O),可以电离出K+,Al3+,SO

②G是黑色固体,D是金属单质,E是常见的双原子气体分子
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:
(3)写出B电解生成E和D的反应方程式:
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式
您最近一年使用:0次



