锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl =2 MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为_________ 。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为_________ (填化学式)。[已知Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
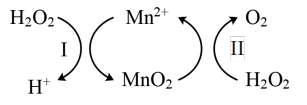
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+ ( aq)=Mn2+ (aq) +O2(g)+2H2O(1) △H2。写出反应 I的热化学方程式(焓变用△H1和△H2表示):_________ 。
②某温度时,向10 mL0.4 mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:
0~2 min时反应速率比2~4 min时的快,其原因是______________ ,0~6 min的平均反应速率v(H2O2)=_________ (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:
①反应I的正反应是_________ (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为_________ 。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl =2 MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:

①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+ ( aq)=Mn2+ (aq) +O2(g)+2H2O(1) △H2。写出反应 I的热化学方程式(焓变用△H1和△H2表示):
②某温度时,向10 mL0.4 mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:
反 应 | 平衡常数Kp | |
| 773K | 873K | |
Ⅰ.CO2(g)+4H2(g) CH4(g)+2H2O(g) CH4(g)+2H2O(g) | 19.4 | 0.803 |
Ⅱ. CO2(g)+3H2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | 6.07 10-9 10-9 | 3.65 10-9 10-9 |
②反应Ⅱ的平衡常数表达式为
更新时间:2016-12-09 14:48:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】甲醇在医药、染料、农药、合成纤维等方面有着广泛的应用。工业上甲醇的合成途径多种多样,有一种方法是用CO和 合成甲醇。现在实验室中模拟甲醇合成的反应,在2L恒容密闭容器内,400℃时发生反应:
合成甲醇。现在实验室中模拟甲醇合成的反应,在2L恒容密闭容器内,400℃时发生反应: ,体系中甲醇的物质的量
,体系中甲醇的物质的量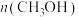 随时间的变化如表:
随时间的变化如表:

(1)图中表示 的浓度变化的曲线是
的浓度变化的曲线是___________ (填字母)。
(2)用CO表示从0~2s内该反应的平均速率
___________ 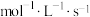 ;2s时
;2s时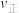
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)已知在400℃时,反应 生成1mol
生成1mol ,放出的热量为akJ,计算上述反应达到平衡时放出的热量
,放出的热量为akJ,计算上述反应达到平衡时放出的热量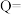
___________ kJ;平衡时向容器中充入1mol ,化学反应速率
,化学反应速率___________ (填“变小”、“不变”或“变大”)。
(4)工业上另一种生产甲醇方法是用 与
与 反应生成甲醇,同时将
反应生成甲醇,同时将 变废为宝。温度压强一定条件下发生反应:
变废为宝。温度压强一定条件下发生反应: ,以下可判断反应已达平衡状态的是___________。
,以下可判断反应已达平衡状态的是___________。
 合成甲醇。现在实验室中模拟甲醇合成的反应,在2L恒容密闭容器内,400℃时发生反应:
合成甲醇。现在实验室中模拟甲醇合成的反应,在2L恒容密闭容器内,400℃时发生反应: ,体系中甲醇的物质的量
,体系中甲醇的物质的量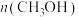 随时间的变化如表:
随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
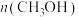 (mol) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |

(1)图中表示
 的浓度变化的曲线是
的浓度变化的曲线是(2)用CO表示从0~2s内该反应的平均速率

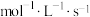 ;2s时
;2s时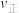
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(3)已知在400℃时,反应
 生成1mol
生成1mol ,放出的热量为akJ,计算上述反应达到平衡时放出的热量
,放出的热量为akJ,计算上述反应达到平衡时放出的热量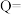
 ,化学反应速率
,化学反应速率(4)工业上另一种生产甲醇方法是用
 与
与 反应生成甲醇,同时将
反应生成甲醇,同时将 变废为宝。温度压强一定条件下发生反应:
变废为宝。温度压强一定条件下发生反应: ,以下可判断反应已达平衡状态的是___________。
,以下可判断反应已达平衡状态的是___________。A.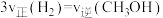 | B.密度不再变化 |
| C.容器内压强不再变化 | D.甲醇和氢气的物质的量之比不再变化 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
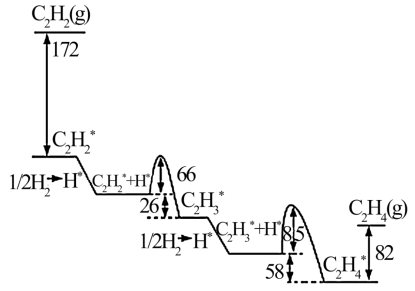
上述吸附反应为_______ (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为_______ kJ·mol-1,该步骤的化学方程式为_______ 。
(2)已知:Fe(s)+CO2(g)⇌FeO(s)+CO(g) ΔH1,平衡常数为K1;
Fe(s)+H2O(g)⇌FeO(s)+H2(g) ΔH2,平衡常数为K2。
在不同温度时K1、K2的值如表:
反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______ (用ΔH1和ΔH2表示),K=_______ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是_______ (填“吸热”或“放热”)反应。
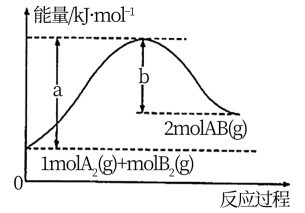
(3)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,请写出该反应的热化学方程式:_______ 。

上述吸附反应为
(2)已知:Fe(s)+CO2(g)⇌FeO(s)+CO(g) ΔH1,平衡常数为K1;
Fe(s)+H2O(g)⇌FeO(s)+H2(g) ΔH2,平衡常数为K2。
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
(3)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,请写出该反应的热化学方程式:

您最近一年使用:0次
【推荐3】氮及其化合物在科研及生产中均有重要的应用。
(1) 转化为
转化为 是工业制取硝酸的重要一步,一定条件下,
是工业制取硝酸的重要一步,一定条件下, 与
与 发生催化氧化反应时,可发生不同反应:
发生催化氧化反应时,可发生不同反应:
反应Ⅰ: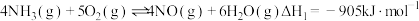
反应Ⅱ: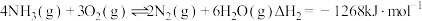
①该条件下, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为_______ .
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中 的物质的量分数在不同温度(
的物质的量分数在不同温度( 、
、 、
、 )随压强的变化如图所示。
)随压强的变化如图所示。
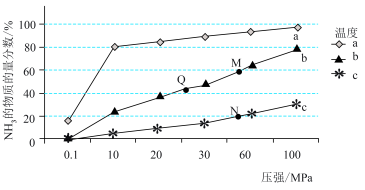
则曲线 对应的温度是
对应的温度是_______ ,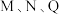 点平衡常数
点平衡常数 的大小关系是
的大小关系是_______ 。
(2)已知: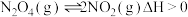 ,将
,将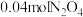 气体充入
气体充入 的恒容密闭容器中,控制反应温度为
的恒容密闭容器中,控制反应温度为 ,
, 随
随 (时间)变化曲线如图。
(时间)变化曲线如图。

①下列各项中能说明该反应已达到化学平衡状态的是_______ 。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
② 时刻反应达到平衡,若
时刻反应达到平衡,若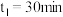 ,计算
,计算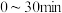 内的平均反应速率
内的平均反应速率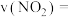
_______ ,此时 的转化率为
的转化率为_______ 。
③反应温度 时,画出
时,画出 时段,
时段, 随
随 变化曲线。保持其他条件不变,改变反应温度为
变化曲线。保持其他条件不变,改变反应温度为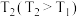 ,再次画出
,再次画出 时段,
时段, 随
随 变化趋势的曲线
变化趋势的曲线____ 。(在答题卡方框中完成 )
(1)
 转化为
转化为 是工业制取硝酸的重要一步,一定条件下,
是工业制取硝酸的重要一步,一定条件下, 与
与 发生催化氧化反应时,可发生不同反应:
发生催化氧化反应时,可发生不同反应:反应Ⅰ:
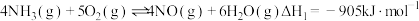
反应Ⅱ:
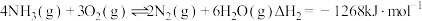
①该条件下,
 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中
 的物质的量分数在不同温度(
的物质的量分数在不同温度( 、
、 、
、 )随压强的变化如图所示。
)随压强的变化如图所示。
则曲线
 对应的温度是
对应的温度是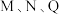 点平衡常数
点平衡常数 的大小关系是
的大小关系是(2)已知:
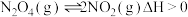 ,将
,将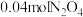 气体充入
气体充入 的恒容密闭容器中,控制反应温度为
的恒容密闭容器中,控制反应温度为 ,
, 随
随 (时间)变化曲线如图。
(时间)变化曲线如图。
①下列各项中能说明该反应已达到化学平衡状态的是
A.容器内压强不变 B.

C.混合气体的颜色不变 D.混合气体的密度不变
②
 时刻反应达到平衡,若
时刻反应达到平衡,若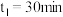 ,计算
,计算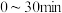 内的平均反应速率
内的平均反应速率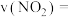
 的转化率为
的转化率为③反应温度
 时,画出
时,画出 时段,
时段, 随
随 变化曲线。保持其他条件不变,改变反应温度为
变化曲线。保持其他条件不变,改变反应温度为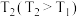 ,再次画出
,再次画出 时段,
时段, 随
随 变化趋势的曲线
变化趋势的曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】习近平主席在第七十五届联合国大会一般性辩论会上表示,中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。CO2可通过反应转化为重要的化工原料。
(1)工业上常用“碳捕捉”技术来“捕捉”空气中的二氧化碳,再把捕捉的二氧化碳提取出来,经化学反应使之变成甲醇(CH3OH)和水,其流程如图所示( 部分反应条件和物质未标出):

①将Y加入X溶液后发生反应的化学方程式为_______ ;_______ 。
②合成塔内的反应条件为300℃,200kPa和催化剂,用CO2来生产燃料甲醇的某些化学键的键能数据如下表:
写出该反应的热化学方程式:_______ 。
③甲醇与CO可以生成醋酸,常温下将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO- ),则醋酸的电离平衡常数为_______ (忽略混合过程中溶液体积的变化,用含a和b的代数式表示)。
(2)CO2可制取二甲醚,热化学方程为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) =-125kJ/mol。往一容积为2L的恒容密闭容器中通入2mol CO2和6mol H2,一定温度下发生该反应,起始总压为P0,20min时达到化学平衡状态,测得CH3OCH3的物质的量分数为12. 5%。
=-125kJ/mol。往一容积为2L的恒容密闭容器中通入2mol CO2和6mol H2,一定温度下发生该反应,起始总压为P0,20min时达到化学平衡状态,测得CH3OCH3的物质的量分数为12. 5%。
①达到化学平衡状态时,下列有关叙述正确的是_______ (填序号)。
a.容器内气体压强不再发生改变
b.正、逆反应速率相等且均为零
c.向容器内再通入1mol CO2和3mol H2,重新达平衡后CH3OCH3体积分数增大
d.向容器内通入少量氦气,则平衡向正反应方向移动
②0~20min内,用H2表示的平均反应速率v( H2)=_______ ,该温度下, 反应的平衡常数Kp=_______ (用含P0的式子表达,用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。
③升高温度,二甲醚的平衡产率_______ (填“增大”“减小”或“不变”)。
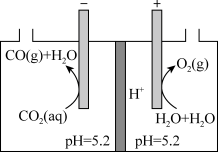
(3)科学家研究将CO2转化为可利用的再生能源是一种理想选择,可用如图所示电化学法进行CO2转化。写出通入CO2一极的电极反应式:_______ 。
(1)工业上常用“碳捕捉”技术来“捕捉”空气中的二氧化碳,再把捕捉的二氧化碳提取出来,经化学反应使之变成甲醇(CH3OH)和水,其流程如图所示( 部分反应条件和物质未标出):

①将Y加入X溶液后发生反应的化学方程式为
②合成塔内的反应条件为300℃,200kPa和催化剂,用CO2来生产燃料甲醇的某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
③甲醇与CO可以生成醋酸,常温下将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO- ),则醋酸的电离平衡常数为
(2)CO2可制取二甲醚,热化学方程为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)
 =-125kJ/mol。往一容积为2L的恒容密闭容器中通入2mol CO2和6mol H2,一定温度下发生该反应,起始总压为P0,20min时达到化学平衡状态,测得CH3OCH3的物质的量分数为12. 5%。
=-125kJ/mol。往一容积为2L的恒容密闭容器中通入2mol CO2和6mol H2,一定温度下发生该反应,起始总压为P0,20min时达到化学平衡状态,测得CH3OCH3的物质的量分数为12. 5%。①达到化学平衡状态时,下列有关叙述正确的是
a.容器内气体压强不再发生改变
b.正、逆反应速率相等且均为零
c.向容器内再通入1mol CO2和3mol H2,重新达平衡后CH3OCH3体积分数增大
d.向容器内通入少量氦气,则平衡向正反应方向移动
②0~20min内,用H2表示的平均反应速率v( H2)=
③升高温度,二甲醚的平衡产率
(3)科学家研究将CO2转化为可利用的再生能源是一种理想选择,可用如图所示电化学法进行CO2转化。写出通入CO2一极的电极反应式:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】自从1909年化学家哈伯研究出合成氨的方法以来,氮的化合物在生产生活中有着广泛应用,与此有关的研究已经获得三次诺贝尔化学奖。目前气态含氮化合物及相关转化依然是科学家研究的热门问题。请回答下列问题:
(1)2007年,诺贝尔化学奖授予了埃特尔,以表彰其对合成氨反应机理的研究。673K时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
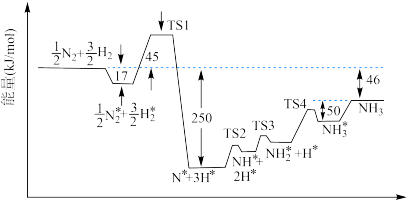
①图1中决速步骤的反应方程式为_______ 。
②相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是_______ 。
(2)用NH3催化还原NO,可以消除氮氧化物的污染。已知:
①

②
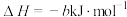
写出NH3还原NO至N2和水蒸气的热化学方程式_______ 。
(3)活性炭还原法是消除氮氧化物污染的有效方法,其原理为
 。已知该反应的正、逆反应速率方程分别为
。已知该反应的正、逆反应速率方程分别为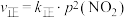 、
、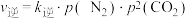 ,其中
,其中 、
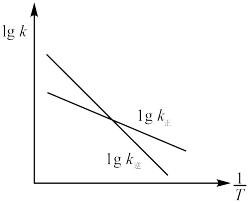
、 分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热
分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热
_______ 0(填“大于”或“小于”),写出推理过程_______ 。
(4)一定温度下,在体积为2L的恒容密闭容器中加入 和
和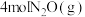 发生反应
发生反应 ,测得
,测得 和
和 的物质的量随时间的变化如图所示:
的物质的量随时间的变化如图所示:

①在A点时,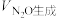
_______ 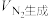 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②若平衡时总压强为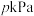 ,用平衡分压代替其平衡浓度表示的化学平衡常数
,用平衡分压代替其平衡浓度表示的化学平衡常数
_______ [已知:气体分压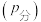 =气体总压
=气体总压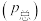 该气体的体积分数]。
该气体的体积分数]。
(1)2007年,诺贝尔化学奖授予了埃特尔,以表彰其对合成氨反应机理的研究。673K时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。

①图1中决速步骤的反应方程式为
②相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是
(2)用NH3催化还原NO,可以消除氮氧化物的污染。已知:
①


②

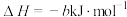
写出NH3还原NO至N2和水蒸气的热化学方程式
(3)活性炭还原法是消除氮氧化物污染的有效方法,其原理为

 。已知该反应的正、逆反应速率方程分别为
。已知该反应的正、逆反应速率方程分别为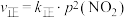 、
、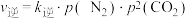 ,其中
,其中 、
、 分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热
分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热

(4)一定温度下,在体积为2L的恒容密闭容器中加入
 和
和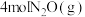 发生反应
发生反应 ,测得
,测得 和
和 的物质的量随时间的变化如图所示:
的物质的量随时间的变化如图所示:
①在A点时,
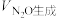
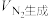 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②若平衡时总压强为
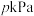 ,用平衡分压代替其平衡浓度表示的化学平衡常数
,用平衡分压代替其平衡浓度表示的化学平衡常数
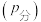 =气体总压
=气体总压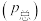 该气体的体积分数]。
该气体的体积分数]。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业上二氧化碳、甲烷催化重整不仅可以获得合成气(CO和H2),还可减少温室气体排放,对治理生态环境具有重要意义。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ/mol
CO(g)+H2O(g)=CO2(g)+H2O(g) △H2=b kJ/mol
2CO(g)+O2(g)=2CO2(g) △H3=c kJ/mol
催化重整反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H4=_______ 。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250-300℃时,温度升高而乙酸的生成速率降低的原因可能是_______ 。
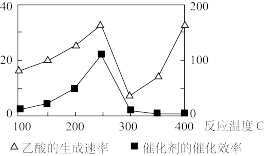
(3)催化重整 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应,测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:
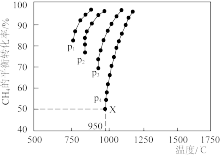
①根据图2可知,p1、p2、p3、p4由大到小的顺序为_______ 。
②在压强为p4、投料比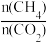 为1、950℃的条件下,X点平衡常数Kp=
为1、950℃的条件下,X点平衡常数Kp=_______ (用含p4的代数式表示,其中用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
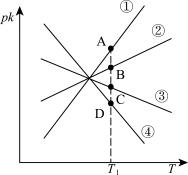
(4)若反应CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度
CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度 所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线_______ ,能表示pk逆随T变化关系的是斜线_______ 。
(5)我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
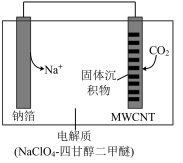
放电时,正极的电极反应式为_______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ/mol
CO(g)+H2O(g)=CO2(g)+H2O(g) △H2=b kJ/mol
2CO(g)+O2(g)=2CO2(g) △H3=c kJ/mol
催化重整反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H4=
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250-300℃时,温度升高而乙酸的生成速率降低的原因可能是

(3)催化重整 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应,测得CH4的平衡转化率与温度及压强的关系如图中曲线所示:

①根据图2可知,p1、p2、p3、p4由大到小的顺序为
②在压强为p4、投料比
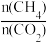 为1、950℃的条件下,X点平衡常数Kp=
为1、950℃的条件下,X点平衡常数Kp= 总压
总压 物质的量分数)。
物质的量分数)。(4)若反应CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度
CO(g)+H2O(g) △H2=+41.17 kJ/mol 的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、k逆分别为正、逆反应速率常数,c为物质的量浓度。则如图(pK=-lgk:T表示温度 所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
(5)我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C,放电时该电池“吸入”CO2,其工作原理如图所示:
放电时,正极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铜电解液中主要含 Cu2+、Ni2+、Fe2+、Fe3+、Ca2+、Zn2+等,为提纯得到粗硫酸镍晶体和胆矾晶体, 某兴趣小组设计了如图流程:
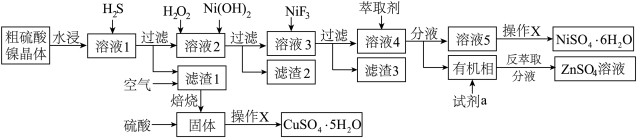
已知:相关离子浓度为0.1mol/L时形成氢氧化物沉淀的pH范围如下:
(1)基态Cu原子的价电子排布式为___________ ,H2O2是___________ (填“极性”或“非极性”)分子。
(2)向“溶液1”中通入稍过量的H2S,写出主要反应的离子方程式:________ 、________ 。
(3)请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因___________ 。
(4)若“溶液3”中Ca2+的浓度为0.002mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为___________ mol/L。【已知室温下Ksp (CaF2)=4×10-11】
(5)室温下选择萃取剂HR,其萃取原理为:nHR+Mn+ MRn+nH+,溶液 pH 对几种离子的萃取率的 影响如图,则萃取锌时,应控制pH的范围为 3~4,请解释原因:
MRn+nH+,溶液 pH 对几种离子的萃取率的 影响如图,则萃取锌时,应控制pH的范围为 3~4,请解释原因:___________ 。试剂a为___________ (填化学式)。

(6)铅和银均为用途广泛的重金属,其中银的一种化合物五唑银(AgN5 )作为新型高能含能材料,在炸药、推进剂等领域具有较高的应用价值。AgN5的立方晶胞结构如图所示,晶胞参数为apm。图中,粒子1的原子分数坐标为( ,
, ,0),则粒子2的原子分数坐标为
,0),则粒子2的原子分数坐标为___________ 。设阿伏加德罗常数的值为NA,则AgN5晶体的密度为___________ g/cm3 (列出计算表达式)。


已知:相关离子浓度为0.1mol/L时形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Ca2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
| 沉淀完全的 pH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |
(2)向“溶液1”中通入稍过量的H2S,写出主要反应的离子方程式:
(3)请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因
(4)若“溶液3”中Ca2+的浓度为0.002mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为
(5)室温下选择萃取剂HR,其萃取原理为:nHR+Mn+
 MRn+nH+,溶液 pH 对几种离子的萃取率的 影响如图,则萃取锌时,应控制pH的范围为 3~4,请解释原因:
MRn+nH+,溶液 pH 对几种离子的萃取率的 影响如图,则萃取锌时,应控制pH的范围为 3~4,请解释原因:
(6)铅和银均为用途广泛的重金属,其中银的一种化合物五唑银(AgN5 )作为新型高能含能材料,在炸药、推进剂等领域具有较高的应用价值。AgN5的立方晶胞结构如图所示,晶胞参数为apm。图中,粒子1的原子分数坐标为(
 ,
, ,0),则粒子2的原子分数坐标为
,0),则粒子2的原子分数坐标为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
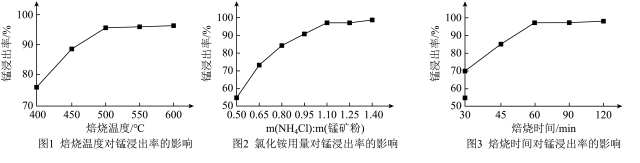
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________ 。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________ ;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________ ;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________ 。
(3)碳化结晶过程中发生反应的离子方程式为______________________ 。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________ 。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HCl气体,溶液中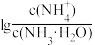 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________ 。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl

已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl
 MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:

(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=
(3)碳化结晶过程中发生反应的离子方程式为
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HCl气体,溶液中
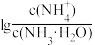 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
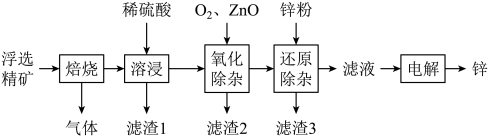
【推荐3】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
请回答下列问题:
(1)焙烧过程中产生的气体化学式__ 。
(2)溶浸时,提高浸出率的方法有____ 。(至少写出两种)
(3)利用Fe(OH)3悬浊液与含SO2的烟气反应生成FeSO4,可以使烟气脱硫,该反应的离子方程式为__ 。产物FeSO4在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__ 。
(4)氧化除杂时,加入ZnO调节溶液pH,当用广泛pH试纸测得pH值为___ 时,可认为已达除杂目的。
A.2 B.2.8 C.4 D.6.2
(5)滤渣3成分为______ 。
(6)若将闪锌矿直接浸入稀硫酸,要使0.10 molZnS完全溶于1LH2SO4(发生反应ZnS+H2SO4 =ZnSO4+H2S),则需H2SO4的最低浓度为___ 。(Ksp[ZnS]=2.5×10-22,H2S的K1=1×10-7,K2=1×10-14,忽略反应前后液体体积变化)

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
请回答下列问题:
(1)焙烧过程中产生的气体化学式
(2)溶浸时,提高浸出率的方法有
(3)利用Fe(OH)3悬浊液与含SO2的烟气反应生成FeSO4,可以使烟气脱硫,该反应的离子方程式为
(4)氧化除杂时,加入ZnO调节溶液pH,当用广泛pH试纸测得pH值为
A.2 B.2.8 C.4 D.6.2
(5)滤渣3成分为
(6)若将闪锌矿直接浸入稀硫酸,要使0.10 molZnS完全溶于1LH2SO4(发生反应ZnS+H2SO4 =ZnSO4+H2S),则需H2SO4的最低浓度为
您最近一年使用:0次



