(1)可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率______________ ;υ(逆)______________ ;
②保持容器体积不变,加入He,则HCl的物质的量__________ 。
③保持容器压强不变,加入He,则O2的物质的量__________ ;
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度____________ ,相对分子质量_________ 。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+ 6C(s) + 2N2(g) Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
①该反应的平衡常数表达式为 K=_________ ;
②若知上述反应为吸热反应,升高温度,其平衡常数值__________ (填“增大”、“减小”或“不变”);若已知CO生成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)=______________ 。
③达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图。图中t4时引起平衡移动的条件可能是______________ ;图中表示平衡混合物中CO的含量最高的一段时间是________________ 。

 4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):①降低温度,Cl2的转化率
②保持容器体积不变,加入He,则HCl的物质的量
③保持容器压强不变,加入He,则O2的物质的量
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+ 6C(s) + 2N2(g)
 Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)①该反应的平衡常数表达式为 K=
②若知上述反应为吸热反应,升高温度,其平衡常数值
③达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图。图中t4时引起平衡移动的条件可能是

更新时间:2016-12-09 09:12:03
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】(1)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:_______________________ 。
(2)某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
①T ℃时,该反应的平衡常数K=________ 。
②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________ (填字母编号)。
a.通入一定量的B b.加入一定量的固体A
c.适当缩小容器的体积 d.升高反应体系温度
③若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________ 0(填“大于”或“小于”),c点v正________ v逆(填“大于”、“小于”或“等于”)。

3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:
(2)某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)
 D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
①T ℃时,该反应的平衡常数K=
②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是
a.通入一定量的B b.加入一定量的固体A
c.适当缩小容器的体积 d.升高反应体系温度
③若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g)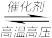 NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K=_______ 。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为_________________ 。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______ ,采取的措施是________ 。
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图象。_________

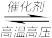 NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
(1)计算反应在第一次平衡时的平衡常数K=
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图象。

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l) ΔH=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H=__________ kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式_______________________ 
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为____________ ;反应达到平衡后,升高温度,此时平衡常数将__________________ (填“变大”、“不变”或“变小”),平衡将向__________ (填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是__________________ 。
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是_____________________________
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l) ΔH=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H=
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式

(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为

(4)为了提高CO的转化率,可采取的措施是
| A.增大的CO浓度 | B.增大的H2O(g)浓度 | C.使用催化剂 | D.降低温度 |
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为
N2 (g)+3H2 (g) 2NH3(g) △H。
2NH3(g) △H。
(1)已知每破坏1mol有关化学键需要的能量如下表:
则△H=_____________ 。
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将_________ (填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
①其中,p1、p2和p3由大到小的顺序是________ ,其原因是__________ 。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___ (保留一位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s) 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____ (填序号)。
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变
N2 (g)+3H2 (g)
 2NH3(g) △H。
2NH3(g) △H。(1)已知每破坏1mol有关化学键需要的能量如下表:
| H-H | N-H | N-N | N N N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H=
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)
 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】利用 催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
反应I:

反应Ⅱ: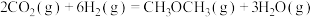

请回答:
(1)反应I的平衡常数表达式为
__________ ;反应Ⅱ发生自发反应的条件是__________ 。
(2)在一定温度和恒容条件下,可以作为判断上述两个反应均达到平衡状态的依据是__________。
(3)在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)

①对于反应I,图中A点时,
__________  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②可能有利于提高 平衡产率的措施有
平衡产率的措施有__________ 。
A.缩小容器的体积 B.升高反应的温度
C.选择更合适于反应Ⅱ的催化剂 D.适当调整 和
和 起始量的比例
起始量的比例
③图中温度高于300℃, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是__________ 。
 催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:反应I:


反应Ⅱ:
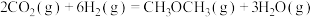

请回答:
(1)反应I的平衡常数表达式为

(2)在一定温度和恒容条件下,可以作为判断上述两个反应均达到平衡状态的依据是__________。
| A.体系内的压强保持不变 | B.两个反应的平衡常数不变 |
C. | D.反应体系中各物质的浓度不变 |
(3)在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
①对于反应I,图中A点时,

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②可能有利于提高
 平衡产率的措施有
平衡产率的措施有A.缩小容器的体积 B.升高反应的温度
C.选择更合适于反应Ⅱ的催化剂 D.适当调整
 和
和 起始量的比例
起始量的比例③图中温度高于300℃,
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是
您最近一年使用:0次
【推荐3】氮氧化物的有效去除和资源的充分利用是当今社会的重要研究课题。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为_______ kJ•mol-1 (用含E逆的代数式表示)。
(2)已知:①2NO(g)+2ICl(g) 2NOCl (g)+I2(g)
2NOCl (g)+I2(g)
②2NOCl(g) 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)
③I2(g)+Cl2(g) 2ICl(g)
2ICl(g)
若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为_______ mol•L-1(用含 a、b、V 的代数式表示,下同),反应③的平衡常数为_______ 。
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g) CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:_______ 。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行,为探究温度及不同催化剂对该反应的影响,保持其它初始条件不变重复实验,在相同时间内测得 N2产率与温度的关系如图所示。在催化剂乙作用下,图中 M 点对应的速率(对应温度400℃)v正_______ (填“>”、“<” 或“=”) v逆,温度高于400℃,N2产率降低的原因可能是_______ 。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为(2)已知:①2NO(g)+2ICl(g)
 2NOCl (g)+I2(g)
2NOCl (g)+I2(g) ②2NOCl(g)
 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)③I2(g)+Cl2(g)
 2ICl(g)
2ICl(g)若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g)
 CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g)⇌2CO2(g) ΔH=−566.0 kJ/mol,② N2(g)+O2(g) 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 kJ/mol。 回答下列问题:
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 kJ/mol。 回答下列问题:
(1)CO的燃烧热为________ 。若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为______ kJ。
(2)CO将NO2还原为单质的热化学方程式为______________ 。
(3)为了模拟反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
① 前2s内的平均反应速率v(N2)=____________ ,此温度下,该反应的平衡常数K=____ 。
② 能说明上述反应达到平衡状态的是__________ 。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③ 当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示,则NO的平衡转化率随温度升高而减小的原因是__________________________________ ,图中压强(p1,p2、p3)的大小顺序为_______ 。

 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 kJ/mol。 回答下列问题:
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 kJ/mol。 回答下列问题:(1)CO的燃烧热为
(2)CO将NO2还原为单质的热化学方程式为
(3)为了模拟反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4 mo l·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3 mo l·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
② 能说明上述反应达到平衡状态的是
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③ 当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示,则NO的平衡转化率随温度升高而减小的原因是

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。在1L固定容积密闭容器中投入1.8molCH4和3.6molH2O(g),若只发生反应:CH4(g)+2H2O(g) CO2(g)+4H2(g) △H1=+165.0kJ·mol-1,测得CH4、H2O及某一生成物X的物质的量浓度随反应时间的变化如图1所示(反应中条件有变化时,只考虑改变一个条件)。
CO2(g)+4H2(g) △H1=+165.0kJ·mol-1,测得CH4、H2O及某一生成物X的物质的量浓度随反应时间的变化如图1所示(反应中条件有变化时,只考虑改变一个条件)。

(1)①CH4(g)+2H2O(g) CO2(g)+4H2(g),说明该反应自发进行的原因:
CO2(g)+4H2(g),说明该反应自发进行的原因:__ 。
②反应在10min时的平衡常数K=__ (列出数学计算式,不必算出结果)。
(2)第6min时改变的条件是__ 。
(3)画出X物质4min~9min之间的变化图象___ 。
(4)反应的过程中发生副反应CO2(g)+CH4(g) CH3COOH(g) △H2=-32.2kJ•mol-1,反应所用的时间和CO2、CH3COOH的产率如图2所示,t时刻后,CO2的产率比CH3COOH低,其原因是
CH3COOH(g) △H2=-32.2kJ•mol-1,反应所用的时间和CO2、CH3COOH的产率如图2所示,t时刻后,CO2的产率比CH3COOH低,其原因是__ 。

(5)我国提出在2030年前实现碳达峰,为了回收CO2有人设计了图3流程,体现了“绿色化学”思想,写出步骤Ⅲ的化学方程式:__ 。

 CO2(g)+4H2(g) △H1=+165.0kJ·mol-1,测得CH4、H2O及某一生成物X的物质的量浓度随反应时间的变化如图1所示(反应中条件有变化时,只考虑改变一个条件)。
CO2(g)+4H2(g) △H1=+165.0kJ·mol-1,测得CH4、H2O及某一生成物X的物质的量浓度随反应时间的变化如图1所示(反应中条件有变化时,只考虑改变一个条件)。
(1)①CH4(g)+2H2O(g)
 CO2(g)+4H2(g),说明该反应自发进行的原因:
CO2(g)+4H2(g),说明该反应自发进行的原因:②反应在10min时的平衡常数K=
(2)第6min时改变的条件是
(3)画出X物质4min~9min之间的变化图象
(4)反应的过程中发生副反应CO2(g)+CH4(g)
 CH3COOH(g) △H2=-32.2kJ•mol-1,反应所用的时间和CO2、CH3COOH的产率如图2所示,t时刻后,CO2的产率比CH3COOH低,其原因是
CH3COOH(g) △H2=-32.2kJ•mol-1,反应所用的时间和CO2、CH3COOH的产率如图2所示,t时刻后,CO2的产率比CH3COOH低,其原因是
(5)我国提出在2030年前实现碳达峰,为了回收CO2有人设计了图3流程,体现了“绿色化学”思想,写出步骤Ⅲ的化学方程式:

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】800℃时,在2L恒容密闭容器中投入0.20molNO和0.12mol O2发生下列反应2NO(g)+O2(g)  2NO2(g),n(NO)随时间的变化情况如下表:
2NO2(g),n(NO)随时间的变化情况如下表:
(1)800℃时,该反应平衡时的NO的物质的量浓度为______ ;升高温度,NO的平衡浓度为0.03mol•L-1,则该反应为_______ 反应(填“放热”或“吸热”)。
(2)用O2表示0~2s内该反应的平均反应速率v(O2)=______ 。
(3)能说明该反应一定达到平衡状态的是______ 。
a v(NO2)=2v(O2) b 容器内压强保持不变
c 容器内气体颜色保持不变 d 容器内气体密度保持不变
(4) 平衡后,下列措施能使该反应向正反应方向移动,且正反应速率增大的是____ 。
a 适当升高温度 b 适当降低温度
c 增大O2的浓度 d 选择高效催化剂
(5)800℃时,上述反应的平衡常数K=______ ,若容器中含1.00 mol•L-1 NO、2.00 mol•L-1O2和2.00 mol•L-1 NO2,则此时v正_______ v逆 (填“>”、“<”或“=”)。
 2NO2(g),n(NO)随时间的变化情况如下表:
2NO2(g),n(NO)随时间的变化情况如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.04 | 0.04 |
(1)800℃时,该反应平衡时的NO的物质的量浓度为
(2)用O2表示0~2s内该反应的平均反应速率v(O2)=
(3)能说明该反应一定达到平衡状态的是
a v(NO2)=2v(O2) b 容器内压强保持不变
c 容器内气体颜色保持不变 d 容器内气体密度保持不变
(4) 平衡后,下列措施能使该反应向正反应方向移动,且正反应速率增大的是
a 适当升高温度 b 适当降低温度
c 增大O2的浓度 d 选择高效催化剂
(5)800℃时,上述反应的平衡常数K=
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)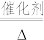 CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
反应开始时,己醇和乙酸甲酯按物质的量之比1∶1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示。

该醇解反应的ΔH___________ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=___________ (保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是___________ ;A、B、C、D四点中,v正最大的是___________ ,v逆最大的是___________ 。
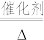 CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。反应开始时,己醇和乙酸甲酯按物质的量之比1∶1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示。

该醇解反应的ΔH
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】(Ⅰ)汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
①反应开始至达到平衡的过程中,容器中下列各项发生变化的是___ (填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
②假设容器体积为5L,则5min内该反应的平均速率υ(NO) =___ ;
(2)H2或CO可以催化还原NO以达到消除污染的目的。
①已知:N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___ ;判断该反应自发进行的条件:___ 。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H___ 0(填“>”或“<”)。若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、 S2条件下达到平衡过程中的变化曲线___ 。
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.

①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___ (填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为__ MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)
 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。①反应开始至达到平衡的过程中,容器中下列各项发生变化的是
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
②假设容器体积为5L,则5min内该反应的平均速率υ(NO) =
(2)H2或CO可以催化还原NO以达到消除污染的目的。
①已知:N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)
 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.

①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】I 可逆反应A(g)+B(g) 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
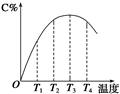
①由T1向T2变化时,正反应速率______ 逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______ 逆反应速率(填“>”、“<”或“=”)。
③反应在________ 温度下达到平衡。
④此反应的正反应为______ 热反应。
II将2 mol I2(g)和1 mol H2置于某2 L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
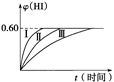
(1)达到平衡时,I2(g)的物质的量浓度为__________ 。
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________ (填入下列条件的序号,下同),乙条件可能是__________ 。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________ 。
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
①由T1向T2变化时,正反应速率
②由T3向T4变化时,正反应速率
③反应在
④此反应的正反应为
II将2 mol I2(g)和1 mol H2置于某2 L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是
您最近一年使用:0次



