锰及其化合物间的转化如下图。

请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:___________ 。反应③发生的主要化学反应的方程式为:___________ 。
(2)粗KMnO4晶体中含有少量的K2CO3,检验其中的少量CO32-用______ 试剂;为了得到纯的KMnO4晶体,操作Ⅲ的名称为___________ 。
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点。写出该反应的离子方程式:___________ 。
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___________________ 。
(5)如图,用Fe、C作电极电解含MnO4-的污水,使之转化为沉淀除去。A电极是_____ (填“Fe”或“C”),污水中MnO4-转化为沉淀除去的离子方程式为___________ 。

请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:
(2)粗KMnO4晶体中含有少量的K2CO3,检验其中的少量CO32-用
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点。写出该反应的离子方程式:
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=
(5)如图,用Fe、C作电极电解含MnO4-的污水,使之转化为沉淀除去。A电极是

更新时间:2017-04-23 23:15:46
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl的水解反应为CuCl(s)+H2O(l) CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=__ 。
(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH=akJ·mol-1。
CH3OH(g) ΔH=akJ·mol-1。
按 =2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
=2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。

①该反应的ΔH__ (填“<”或“>”)0,图中p1、p2、p3由大到小的顺序是__ 。
②起始时,甲容器中c(H2)=0.20mol·L-1,c(CO)=0.10mol·L-1,在p3及T1℃下反应达到平衡,此时反应的平衡常数为__ 。起始时,乙容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,T1℃下反应达到平衡,CO的平衡转化率__ 。
A.大于40% B.小于40%
C.等于40% D.等于80%
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl的水解反应为CuCl(s)+H2O(l)
 CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)
 CH3OH(g) ΔH=akJ·mol-1。
CH3OH(g) ΔH=akJ·mol-1。按
 =2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
=2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
①该反应的ΔH
②起始时,甲容器中c(H2)=0.20mol·L-1,c(CO)=0.10mol·L-1,在p3及T1℃下反应达到平衡,此时反应的平衡常数为
A.大于40% B.小于40%
C.等于40% D.等于80%
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg•L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=____ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____ [填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol•L-1时,废水中Cd2+的浓度为____ mol•L-1[已知:Ksp(CdS)=7.9×10-27],此时_____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表:
25℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____ 。
(5)常温下,向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液的pH=____ 。
②如果向反应后的溶液中继续加入50mL0.001mol•L-1的盐酸,____ (填“有”或“无”)白色沉淀生成。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol•L-1时,废水中Cd2+的浓度为
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(5)常温下,向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液的pH=
②如果向反应后的溶液中继续加入50mL0.001mol•L-1的盐酸,
您最近一年使用:0次
【推荐3】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。

(1) 当有1 mol Na+通过阳离子交换膜时,a极生成气体____ L(标准状况),阳极的电极反应式是_____ 。
(2)稀NaOH溶液的作用是________ ,B处流出较浓的NaOH溶液,C处流出的是___________ 。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40 m3,理论上需要消耗甲烷_______ m3。
已知:Ksp[Fe(OH)2]=8×10-16,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=4×10-17,回答下列问题:
(4)Fe(OH)3溶解平衡常数表达式Ksp[Fe(OH)3]=___________________ 。
(5)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是______ 。常温下,若使0.4 mol·L-1的ZnCl2溶液中的Zn2+开始沉淀,应加入NaOH溶液调整溶液的pH为______ 。
(6)要除去ZnCl2酸性溶液中混有的少量Fe2+,应先向混合溶液中加入适量_________ 溶液,再加入________ (填下列选项序号)调节溶液的pH,最后过滤。
a. NH3·H2O b. Na2CO3 c. ZnO d. ZnCO3

(1) 当有1 mol Na+通过阳离子交换膜时,a极生成气体
(2)稀NaOH溶液的作用是
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40 m3,理论上需要消耗甲烷
已知:Ksp[Fe(OH)2]=8×10-16,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=4×10-17,回答下列问题:
(4)Fe(OH)3溶解平衡常数表达式Ksp[Fe(OH)3]=
(5)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是
(6)要除去ZnCl2酸性溶液中混有的少量Fe2+,应先向混合溶液中加入适量
a. NH3·H2O b. Na2CO3 c. ZnO d. ZnCO3
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮氧化物(NOx)、CO2和SO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的。
(1)利用甲烷催化还原NOx。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H1=−572 kJ∙mol−1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2=−1160 kJ∙mol−1
则甲烷将NO2还原为N2并生成气态水时的热化学方程式为_______ 。
(2)利用 CO2生成甲醇燃料。已知: ,将6mol CO2和8mol H2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
,将6mol CO2和8mol H2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:

①该反应在0~8 内CO2的平均反应速率为
内CO2的平均反应速率为_______ 。
②该反应10分钟时的平衡常数K =_______ 。
③仅改变某一条件再进行实验,测得H2的物质的量随时间的变化曲线如图1虚线所示。与实线相比,虚线改变的外界条件可能是_______ 。
(3)工业上利用CO与H2反应合成甲醇。已知: ,在一恒容密闭容器中,按照
,在一恒容密闭容器中,按照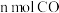 和
和 投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是_______(填字母)。
投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是_______(填字母)。

(4)利用如图3所示装置(电极均为惰性电极)可吸收 ,阳极的电极反应式为
,阳极的电极反应式为_______ 。

(5)常温下, ,
, ,控制条件可实现如下沉淀转换:
,控制条件可实现如下沉淀转换: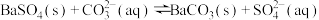 。欲用
。欲用 溶液将
溶液将 全部转化为
全部转化为 ,此时溶液中
,此时溶液中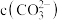 为
为_______ 。
(1)利用甲烷催化还原NOx。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H1=−572 kJ∙mol−1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2=−1160 kJ∙mol−1
则甲烷将NO2还原为N2并生成气态水时的热化学方程式为
(2)利用 CO2生成甲醇燃料。已知:
 ,将6mol CO2和8mol H2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
,将6mol CO2和8mol H2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
①该反应在0~8
 内CO2的平均反应速率为
内CO2的平均反应速率为②该反应10分钟时的平衡常数K =
③仅改变某一条件再进行实验,测得H2的物质的量随时间的变化曲线如图1虚线所示。与实线相比,虚线改变的外界条件可能是
(3)工业上利用CO与H2反应合成甲醇。已知:
 ,在一恒容密闭容器中,按照
,在一恒容密闭容器中,按照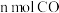 和
和 投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是_______(填字母)。
投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是_______(填字母)。
A.温度: |
B.正反应速率: 、 、 |
C.平衡常数: 、 、 |
D.平均摩尔质量: 、 、 |
 ,阳极的电极反应式为
,阳极的电极反应式为
(5)常温下,
 ,
, ,控制条件可实现如下沉淀转换:
,控制条件可实现如下沉淀转换: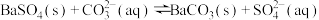 。欲用
。欲用 溶液将
溶液将 全部转化为
全部转化为 ,此时溶液中
,此时溶液中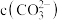 为
为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氨是化肥工业和基本有机化工业的主要原料,随着科学技术的发展,对氨的需求量日益增长。
(1)已知: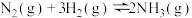
 。在恒容密闭容器中,一定条件下该反应的进程或结果如图1和图2:
。在恒容密闭容器中,一定条件下该反应的进程或结果如图1和图2:

①图1中温度
______  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
②图1中 、
、 、
、 三点
三点 的转化率由大到小的顺序是
的转化率由大到小的顺序是______ (填字母)。
③图2中 时改变的条件可能是
时改变的条件可能是__________________ 。(填一种可能)
(2)已知:氨的分解反应为 。在T℃时,向体积为
。在T℃时,向体积为 的恒容密闭容器中加入
的恒容密闭容器中加入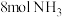 和
和 ,达到平衡时
,达到平衡时 的体积为总体积的
的体积为总体积的 。则氨气的分解率为
。则氨气的分解率为______ ;该温度下的平衡常数为______ 。
(3)我国科学家实现了在室温下电催化 制取
制取 和
和 ,装置如图所示,其中双极膜复合层之间的水能解离成
,装置如图所示,其中双极膜复合层之间的水能解离成 和
和 ,双极膜能实现
,双极膜能实现 、
、 的定向移动。
的定向移动。

①电解时,双极膜产生的 向
向______ (填“ ”或“
”或“ ”)极移动,该电极连接太阳能电池的
”)极移动,该电极连接太阳能电池的______ (填“正”或“负”)极。
②电解的阴极反应式为__________ 。
(1)已知:
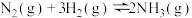
 。在恒容密闭容器中,一定条件下该反应的进程或结果如图1和图2:
。在恒容密闭容器中,一定条件下该反应的进程或结果如图1和图2:
①图1中温度

 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。②图1中
 、
、 、
、 三点
三点 的转化率由大到小的顺序是
的转化率由大到小的顺序是③图2中
 时改变的条件可能是
时改变的条件可能是(2)已知:氨的分解反应为
 。在T℃时,向体积为
。在T℃时,向体积为 的恒容密闭容器中加入
的恒容密闭容器中加入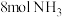 和
和 ,达到平衡时
,达到平衡时 的体积为总体积的
的体积为总体积的 。则氨气的分解率为
。则氨气的分解率为(3)我国科学家实现了在室温下电催化
 制取
制取 和
和 ,装置如图所示,其中双极膜复合层之间的水能解离成
,装置如图所示,其中双极膜复合层之间的水能解离成 和
和 ,双极膜能实现
,双极膜能实现 、
、 的定向移动。
的定向移动。
①电解时,双极膜产生的
 向
向 ”或“
”或“ ”)极移动,该电极连接太阳能电池的
”)极移动,该电极连接太阳能电池的②电解的阴极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】利用化学反应原理的知识可以有效的服务于生产和生活当中。
Ⅰ.工业生产中经常用性还原处理氧化物,起到了很好的效果。有关反应为C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式____ 。
(2)在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
①结合表中数据,判断该反应的△H____ 0(填“>”或“<”)。
②判断该反应达到平衡状态的依据是____ 。(填字母)。
A.2v正(NO)=v逆(N2) B.容器内各气体浓度恒定
C.容器内压强恒定 D.容器内气体平均相对分子质量恒定
(3)Ⅱ.镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图1为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的____ (填“正”或“负”)极。F电极上的电极反应式为____ 。

(4)乙醛酸(HCOOH—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图2所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。

①N电极上的电极反应式为____ 。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为____ mol。
Ⅰ.工业生产中经常用性还原处理氧化物,起到了很好的效果。有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)。
N2(g)+CO2(g)。(1)写出上述反应的平衡常数表达式
(2)在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
| 实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
②判断该反应达到平衡状态的依据是
A.2v正(NO)=v逆(N2) B.容器内各气体浓度恒定
C.容器内压强恒定 D.容器内气体平均相对分子质量恒定
(3)Ⅱ.镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图1为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的

(4)乙醛酸(HCOOH—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图2所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。

①N电极上的电极反应式为
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】 的制备实验是实验研究的热点,某化学学习小组设计了如图所示装置(夹持仪器省略)制备氢氧化亚铁。
的制备实验是实验研究的热点,某化学学习小组设计了如图所示装置(夹持仪器省略)制备氢氧化亚铁。
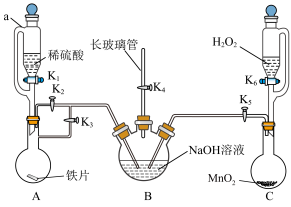
实验步骤如下:
Ⅰ.检查装置气密性后,关闭K2、K5、K6,打开K1、K3、K4使装置A中产生的气体进入装置B中,排尽B中空气。
Ⅱ.待B中空气排尽后,关闭K3,打开K2,将A中溶液压入B中并观察现象。
Ⅲ.关闭K1、K2,打开K5、K6,使C中气体通入B中并观察现象。
回答下列问题:
(1)仪器a的名称是_____ ,B中长玻璃管的作用是_____ 。
(2)装置A中金属离子的检验方法是_____
(3)步骤Ⅲ装置B中的现象是_____ ,其发生反应的化学方程式为_____ 。
(4)在FeSO4溶液中加入 固体可制备摩尔盐晶体[
固体可制备摩尔盐晶体[ ](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①从摩尔盐水溶液中提取 晶体的具体操作是
晶体的具体操作是_____ 。
②为了测定产品的纯度,称取10g产品溶于50mL水中,配制成250mL溶液,用浓度为 的酸性KMnO4溶液滴定,每次所取待测液体积均为25.00mL。实验结果记录如下:
的酸性KMnO4溶液滴定,每次所取待测液体积均为25.00mL。实验结果记录如下:
通过实验数据计算该产品纯度为_____ ,上表中第一次实验中记录数据明显大于后两次,其原因可能是_____ 。
A.第一次滴定前滴定管尖嘴有气泡
B.第一次实验结束时俯视刻度线读取酸性高锰酸钾溶液的体积
C.第一次滴定用的锥形瓶用待测液润洗过
D.第一次实验装高锰酸钾的滴定管清洗后没有润洗
 的制备实验是实验研究的热点,某化学学习小组设计了如图所示装置(夹持仪器省略)制备氢氧化亚铁。
的制备实验是实验研究的热点,某化学学习小组设计了如图所示装置(夹持仪器省略)制备氢氧化亚铁。
实验步骤如下:
Ⅰ.检查装置气密性后,关闭K2、K5、K6,打开K1、K3、K4使装置A中产生的气体进入装置B中,排尽B中空气。
Ⅱ.待B中空气排尽后,关闭K3,打开K2,将A中溶液压入B中并观察现象。
Ⅲ.关闭K1、K2,打开K5、K6,使C中气体通入B中并观察现象。
回答下列问题:
(1)仪器a的名称是
(2)装置A中金属离子的检验方法是
(3)步骤Ⅲ装置B中的现象是
(4)在FeSO4溶液中加入
 固体可制备摩尔盐晶体[
固体可制备摩尔盐晶体[ ](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。①从摩尔盐水溶液中提取
 晶体的具体操作是
晶体的具体操作是②为了测定产品的纯度,称取10g产品溶于50mL水中,配制成250mL溶液,用浓度为
 的酸性KMnO4溶液滴定,每次所取待测液体积均为25.00mL。实验结果记录如下:
的酸性KMnO4溶液滴定,每次所取待测液体积均为25.00mL。实验结果记录如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定前滴定管尖嘴有气泡
B.第一次实验结束时俯视刻度线读取酸性高锰酸钾溶液的体积
C.第一次滴定用的锥形瓶用待测液润洗过
D.第一次实验装高锰酸钾的滴定管清洗后没有润洗
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取 B.升华 C.结晶 D.分液 E蒸馏 F.过滤
①分离饱和食盐水与沙子的混合物。___ ;
②从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体。___ ;
③分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的互溶混合物。___ ;
④分离NaCl固体和单质碘固体的混合物。__ 。
A.萃取 B.升华 C.结晶 D.分液 E蒸馏 F.过滤
①分离饱和食盐水与沙子的混合物。
②从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体。
③分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的互溶混合物。
④分离NaCl固体和单质碘固体的混合物。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:
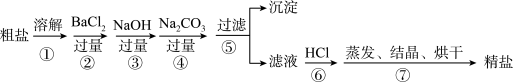
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______ 。
(2)第②步操作的目的是除去粗盐中的______ (填化学式,下同),第⑥步操作的目的是除去滤液中______ 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______ (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______ 。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______ 。

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是
您最近一年使用:0次
【推荐1】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶
液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是_________ (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是__________________ 。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为______________ 。
(4)甲同学最终确定原溶液中所含阳离子是__________ ,阴离子是_________ (写离子符号)。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶
液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
(4)甲同学最终确定原溶液中所含阳离子是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某澄清透明的溶液中可能有Fe2+、Fe3+、Al3+、Ba2+、SO42-、HCO3-、NO3-、Cl-等离子,对其进行下述实验:
(A)该溶液能使紫色石蕊试液变红;
(B)另取少量溶液浓缩后加入铜片和浓硫酸共热,可看到有红棕色的NO2气体生成;
(C)另取少量溶液加入氯化钡溶液,产生不溶于稀硝酸的白色沉淀,并过滤;
(D)在(C)所得滤液中加入硝酸银溶液,也产生不溶于稀硝酸的白色沉淀;
(E)另取滤液,逐滴加入氢氧化钠溶液至过量,开始时沉淀逐渐增加,随后沉淀部分溶解,最后仍然有固体残留;根据此实验现象,判断:
(1)溶液中肯定存在的离子有_____________ 。(2)溶液中肯定不存在的离子是___________ 。
(A)该溶液能使紫色石蕊试液变红;
(B)另取少量溶液浓缩后加入铜片和浓硫酸共热,可看到有红棕色的NO2气体生成;
(C)另取少量溶液加入氯化钡溶液,产生不溶于稀硝酸的白色沉淀,并过滤;
(D)在(C)所得滤液中加入硝酸银溶液,也产生不溶于稀硝酸的白色沉淀;
(E)另取滤液,逐滴加入氢氧化钠溶液至过量,开始时沉淀逐渐增加,随后沉淀部分溶解,最后仍然有固体残留;根据此实验现象,判断:
(1)溶液中肯定存在的离子有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.下表有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液)。
根据该表回答问题:
(1)第Ⅱ组物质中与第Ⅰ组任何物质都不发生反应的是___________ 。
(2)第Ⅱ组物质中与第Ⅲ组任何物质都能发生反应的是___________ 。
(3)第Ⅲ组中与其他两种物质不同类的是___________ 。
(4)第Ⅲ组中有一种物质能与第___________ 组中的所有物质反应,这种物质是___________ 。
Ⅱ.某无色溶液中可能含Mg2+、Cu2+、Ba2+、CO 、Cl−、
、Cl−、 、NO
、NO 中的几种,现进行如下实验:
中的几种,现进行如下实验:
①取适量溶液,加入足量NaOH溶液,生成白色沉淀。
②过滤,向实验Ⅰ所得的滤液中加入足量 溶液,有白色沉淀生成。根据上述实验回答下列问题。
溶液,有白色沉淀生成。根据上述实验回答下列问题。
(5)溶液中一定不存在的离子是___________ ;
(6)写出①和②中所发生反应的离子方程式___________ 、___________ ;
(7)为了验证溶液中是否存在Cl−、NO ,某同学提出下列假设:
,某同学提出下列假设:
①只存在Cl−;②Cl−、NO 同时存在;③
同时存在;③___________
已知实验提供的试剂只有稀盐酸, 溶液、稀硝酸、NaOH溶液和蒸馏水。
溶液、稀硝酸、NaOH溶液和蒸馏水。
实验方法:___________
实验现象:___________
实验结论:假设③正确。
| 第I组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Mg | NaOH | MgCl2 |
(1)第Ⅱ组物质中与第Ⅰ组任何物质都不发生反应的是
(2)第Ⅱ组物质中与第Ⅲ组任何物质都能发生反应的是
(3)第Ⅲ组中与其他两种物质不同类的是
(4)第Ⅲ组中有一种物质能与第
Ⅱ.某无色溶液中可能含Mg2+、Cu2+、Ba2+、CO
 、Cl−、
、Cl−、 、NO
、NO 中的几种,现进行如下实验:
中的几种,现进行如下实验:①取适量溶液,加入足量NaOH溶液,生成白色沉淀。
②过滤,向实验Ⅰ所得的滤液中加入足量
 溶液,有白色沉淀生成。根据上述实验回答下列问题。
溶液,有白色沉淀生成。根据上述实验回答下列问题。(5)溶液中一定不存在的离子是
(6)写出①和②中所发生反应的离子方程式
(7)为了验证溶液中是否存在Cl−、NO
 ,某同学提出下列假设:
,某同学提出下列假设:①只存在Cl−;②Cl−、NO
 同时存在;③
同时存在;③已知实验提供的试剂只有稀盐酸,
 溶液、稀硝酸、NaOH溶液和蒸馏水。
溶液、稀硝酸、NaOH溶液和蒸馏水。实验方法:
实验现象:
实验结论:假设③正确。
您最近一年使用:0次



