硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
(1)B装置的作用是_________________________________________ 。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有____________ 气体产生,写出D中发生反应的离子方程式______________________ 。若去掉C,能否得出同样结论____________ (填“是”或“否”) ,原因是____________________________ 。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为________________________ 。
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式_______________ 。
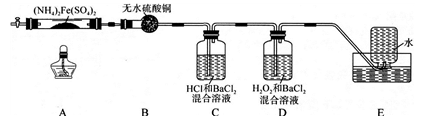
(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式
更新时间:2017-05-07 19:44:37
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】某工厂用含NH4+废水处理工业废气(其化学成分为CO2、SO2、NO,不考虑其他成分)的工艺流程如下:

(1)固体1的主要成分为Ca(OH)2、___________ 。
(2)气体2无毒性,写出处理含NH4+废水时所发生反应的离子方程式:_________________________ 。
(3)查阅资料可知:向2mol气体1中通入不同量的O2,并将所得混合气体通入NaOH溶液中,有关含氮组分的物质的量变化如图所示。

上述工艺流程中气体1与O2的体积比(相同条件)应控制为_____________________________ 。
(4)为测定上述流程中所得NaNO2溶液的物质的量浓度,准确量取10.00mLNaNO2溶液样品与24.00mL0.05mol/L过量的酸性KMnO4溶液充分反应,反应后所得溶液用0.1mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去,消耗(NH4)2Fe(SO4)2溶液10.00mL。
通过计算确定NaNO2溶液的物质的量浓度(写出计算过程)。_________________

(1)固体1的主要成分为Ca(OH)2、
(2)气体2无毒性,写出处理含NH4+废水时所发生反应的离子方程式:
(3)查阅资料可知:向2mol气体1中通入不同量的O2,并将所得混合气体通入NaOH溶液中,有关含氮组分的物质的量变化如图所示。

上述工艺流程中气体1与O2的体积比(相同条件)应控制为
(4)为测定上述流程中所得NaNO2溶液的物质的量浓度,准确量取10.00mLNaNO2溶液样品与24.00mL0.05mol/L过量的酸性KMnO4溶液充分反应,反应后所得溶液用0.1mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去,消耗(NH4)2Fe(SO4)2溶液10.00mL。
通过计算确定NaNO2溶液的物质的量浓度(写出计算过程)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为___________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将 、NO、
、NO、 转化为
转化为 。
。
①在SCR脱硝的反应中还原剂为___________ (填化学式)。
②若 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理___________ (用化学方程式表示)。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量( 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量___________ (用 表示,写出计算过程)。
表示,写出计算过程)。
 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成
 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将
 、NO、
、NO、 转化为
转化为 。
。①在SCR脱硝的反应中还原剂为
②若
 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(
 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量 表示,写出计算过程)。
表示,写出计算过程)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4,利用如图所示的实验装置进行实验。

已知:①SO2熔点为-72℃,沸点为-10℃ ② SO3熔点为-16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是_________________________
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为_________ 色,写出该反应的化学方程式___________________ 。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是__________________ , 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是 _______________
实验二 探究高温分解 FeSO4生成的气体
(4)用如图所示装置设计实验,验证高温分解FeSO4生成的气态物质

①按气流方向连接各仪器,用字母表示接口的连接顺序:c-__________________________
②试剂X的名称是___________________________
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。若最终得到沉淀的质量为Wg ,则已分解的FeSO4的质量________________ g。
实验一:高温分解FeSO4,利用如图所示的实验装置进行实验。

已知:①SO2熔点为-72℃,沸点为-10℃ ② SO3熔点为-16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是
实验二 探究高温分解 FeSO4生成的气体
(4)用如图所示装置设计实验,验证高温分解FeSO4生成的气态物质

①按气流方向连接各仪器,用字母表示接口的连接顺序:c-
②试剂X的名称是
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。若最终得到沉淀的质量为Wg ,则已分解的FeSO4的质量
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】为测定某地空气中SO2和可吸入颗粒的含量,某同学设计了如下图所示的实验装置:

注:气体流速管是用来测量单位时间内通过气体体积的装置
(1)上述实验测定原理为_________________________________ (用化学方程式表示)。
(2)应用上述装置测定空气中SO2和可吸入颗粒的含量,除需测定气体流速(单位:mL·s-1)外,还需要测定碘溶液蓝色褪去所需的时间和___________________________ 。
(3)已知:碘单质微溶于水,KI可以增大碘在水中溶解度。为精确配制100 mL 5.0×10-4mol·L-1的碘溶液,先要配制1000 mL 1.0×10-2mol·L-1碘溶液,再取5.00 mL溶液稀释成为5.0×10-4mol·L-1碘溶液。
①第一步:用托盘天平称取___ g 碘单质加入烧杯中,同时加入少量碘化钾固体,加适量水搅拌使之完全溶解。
②第二步:________________ ,洗涤、定容、摇匀。
③第三步:用第二步所得溶液配制5.0×10-4mol·L-1碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有________________________ 。
(4)空气中SO2含量的测定:
①已知空气中二氧化硫的最大允许排放浓度不得超过0.02mg·L-1,在指定的地点取样,以200mL·s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,则该地空气中的SO2含量是________ mg·L-1,____________ (填“符合”、“不符合”)排放标准。
②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,其原因可能是________________________________ (假设溶液配制、称量或量取及各种读数均无错误。写出一种可能原因即可)

注:气体流速管是用来测量单位时间内通过气体体积的装置
(1)上述实验测定原理为
(2)应用上述装置测定空气中SO2和可吸入颗粒的含量,除需测定气体流速(单位:mL·s-1)外,还需要测定碘溶液蓝色褪去所需的时间和
(3)已知:碘单质微溶于水,KI可以增大碘在水中溶解度。为精确配制100 mL 5.0×10-4mol·L-1的碘溶液,先要配制1000 mL 1.0×10-2mol·L-1碘溶液,再取5.00 mL溶液稀释成为5.0×10-4mol·L-1碘溶液。
①第一步:用托盘天平称取
②第二步:
③第三步:用第二步所得溶液配制5.0×10-4mol·L-1碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有
(4)空气中SO2含量的测定:
①已知空气中二氧化硫的最大允许排放浓度不得超过0.02mg·L-1,在指定的地点取样,以200mL·s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,则该地空气中的SO2含量是
②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,其原因可能是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】某化合物A含有3种元素,现有研究小组对其进行如下实验:
(1)组成A的元素有___________ (写元素符号)。
(2)A的化学式为___________ 。
(3)写出气体C与溴水反应的离子方程式___________ 。
(4)样品A与双氧水反应,得到溶液F,溶液F的溶质之一为强酸,写出化学方程式;___________ 。
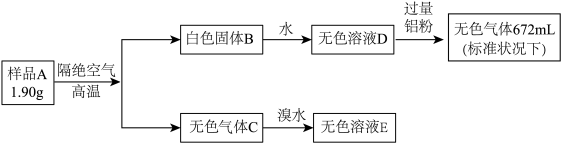
(1)组成A的元素有
(2)A的化学式为
(3)写出气体C与溴水反应的离子方程式
(4)样品A与双氧水反应,得到溶液F,溶液F的溶质之一为强酸,写出化学方程式;
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
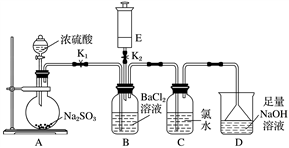
实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________ 。
(2)写出C中反应的化学方程式:_______________________________________ 。
(3)D的作用是___________________________________________________ ,
反应的离子方程式为_______________________________________________ 。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________ ,
反应的离子方程式为_______________________________________________ 。

实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是
(2)写出C中反应的化学方程式:
(3)D的作用是
反应的离子方程式为
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是
反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐1】甲、乙、丙三种物质之间有如图所示的转化关系:

(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_____ (填化学式).
写出反应的化学方程式
①甲→乙_____ .
②乙→丙_____ .
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是_____ (填化学式).写出反应的离子方程式:
①甲→乙_____ .
②乙→丙_____ .

(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是
写出反应的化学方程式
①甲→乙
②乙→丙
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是
①甲→乙
②乙→丙
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如图实验:
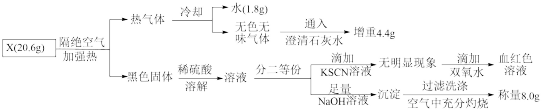
请回答:
(1)X的化学式____ 。
(2)X隔绝空气加热的化学反应方程式为:___ 。
(3)用化学方程式表示在空气中变黄的原因____ 。
(4)写出检验溶液A中存在的金属阳离子的实验方法:____ 。

请回答:
(1)X的化学式
(2)X隔绝空气加热的化学反应方程式为:
(3)用化学方程式表示在空气中变黄的原因
(4)写出检验溶液A中存在的金属阳离子的实验方法:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度,工艺流程如下所示:
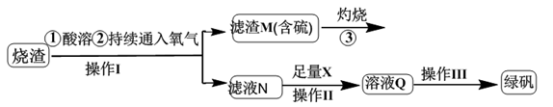
(1)烧渣在进行酸溶时用到的酸为___________ 。
(2)过程灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
(3)X是_______ ,此时滤液N中发生反应的离子方程式为____________ 。检验溶液Q中含有的金属阳离子的实验方法是__________________ 。
(4)操作III的操作步骤为蒸发浓缩、_________ 、过滤(填操作名称)、________ 、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在________ 滴定管中(填“酸式”或“碱式”)
计算上述产品中FeSO4·7H2O的质量分数为_________ ;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数______ 。(填“偏大”“偏小”或“无影响”)。

(1)烧渣在进行酸溶时用到的酸为
(2)过程灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
| A.品红溶液 | B.紫色石蕊溶液 | C.酸性KMnO4溶液 | D.红色的酚酞试液 |
(3)X是
(4)操作III的操作步骤为蒸发浓缩、
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在
计算上述产品中FeSO4·7H2O的质量分数为
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制的FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再加入浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学们的好奇心与求知欲望,他们对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是____________________________________________ 。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。根据C、S、N的原子结构和共价键的相关知识推断SCN-的结构式为_______________________________________________________ 。
(3)根据乙同学的,观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀。(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:________________________________ 。
(4)丙同学认为SCN-的性质 还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,而加入过量的碘水时溶液的颜色基本不变。丙同学的设计意图是__________________________________________________________ 。
(5)通过本次探究,可知用SCN-间接检验Fe2+时应注意_______________________________ 。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。根据C、S、N的原子结构和共价键的相关知识推断SCN-的结构式为
(3)根据乙同学的,观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀。(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:
(4)丙同学认为SCN-的性质 还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,而加入过量的碘水时溶液的颜色基本不变。丙同学的设计意图是
(5)通过本次探究,可知用SCN-间接检验Fe2+时应注意
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】如图是某研究性学习小组设计制取氯气,并以氯气为反应物进行特定反应的装置。
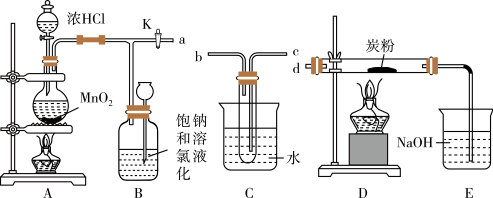
(1)要将C装置接入B和D之间,正确的接法是:a→___ →__ →d。
(2)实验开始时先点燃A处酒精灯,打开旋塞K,让Cl2刚好充满整个装置,再点燃D处酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为___ 。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___ ,B的作用是___ 。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由__ 。
(5)实验结束后,测得D装置质量减轻1.92g,E中NaOH溶液(足量)增重36.08g,可算出D中反应的氯气转化率为___ (转化率=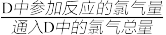 )。
)。
(6)用题中装置测得的氯气转化率会___ (填:偏低、偏高、不确定)。请指出引起结果偏差的原因并提出改进意见___ 。

(1)要将C装置接入B和D之间,正确的接法是:a→
(2)实验开始时先点燃A处酒精灯,打开旋塞K,让Cl2刚好充满整个装置,再点燃D处酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由
(5)实验结束后,测得D装置质量减轻1.92g,E中NaOH溶液(足量)增重36.08g,可算出D中反应的氯气转化率为
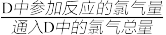 )。
)。(6)用题中装置测得的氯气转化率会
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】已知反应MgCl2+6NH3 MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。

相关物质的性质见下表:
完成下列填空:
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为_________ ,图1中虚框内装置的作用是_______________________________ 。
(2)氨化过程采用冰水浴的原因可能是_____ (选填编号)。
a.氨化过程吸热,促进反应正向进行b.加快反应速率
c.防止氨气挥发,提高氨气利用率d.增大产物的溶解度
氨化结束后,从混合体系中分离MgCl2·6NH3所需的玻璃仪器除烧杯外,还有_____ 。
(3)进行放氨实验时,三颈烧瓶中加入MgCl2·6NH3和足量烧碱的浓溶液,加热,并不断通入N2,通入N2目的是_______________________________________ 。
(4)通过观察图2烧杯中现象的变化可以监控放氨的程度,若加入MgCl2·6NH3的物质的量为0.010mol,要判断放氨率是否达到或超过90%,烧杯中溶液可以是含有少量指示剂______ (填名称)和_____ molH+的强酸溶液。
 MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
相关物质的性质见下表:
| 物质名称 | 溶解性 | ||
| NH3 | MgCl2 | MgCl2·6NH3 | |
| 水 | 易溶 | 易溶 | 易溶 |
| 乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为
(2)氨化过程采用冰水浴的原因可能是
a.氨化过程吸热,促进反应正向进行b.加快反应速率
c.防止氨气挥发,提高氨气利用率d.增大产物的溶解度
氨化结束后,从混合体系中分离MgCl2·6NH3所需的玻璃仪器除烧杯外,还有
(3)进行放氨实验时,三颈烧瓶中加入MgCl2·6NH3和足量烧碱的浓溶液,加热,并不断通入N2,通入N2目的是
(4)通过观察图2烧杯中现象的变化可以监控放氨的程度,若加入MgCl2·6NH3的物质的量为0.010mol,要判断放氨率是否达到或超过90%,烧杯中溶液可以是含有少量指示剂
您最近一年使用:0次



