钼是一种稀有金属,为人体及动植物必须的微量元素,纯金属钼和钼合金具有强度大、耐高温、耐磨损、耐腐蚀等多种有点,广泛应用于冶金、机械、化工、军工、电光源、润滑剂、航空航天等领域。某化学兴趣小组在实验室模拟了从铜钼精矿(主要含有Cu2S、MoS2,SiO2,P,As等)中提取分离得到氧化钼的过程:
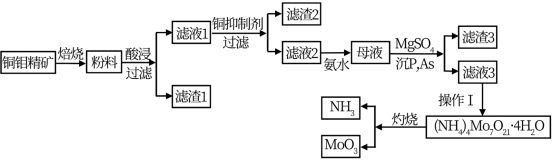
已知:MoO3在869.9K温度下开始升华,而到969.9温度下激烈升华,在溶液中以H2MoO4形式存在
(1)滤渣1的主要成分为_________________________ 。
(2)铜钼矿中的钼元素在过量的空气中,于一定温度下,很容易氧化成MoO3,其方程式为___________________________________ ,
焙烧过程中应控制在800-870K左右,其原因为____________________________ 。
(3)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式_______________________________ ;
②由干氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用深漂白粉或漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式_____ ;
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;滤液中的Cu2+的浓度为为0.5mol/L、.当溶液中离子浓度小于等于1.00×10-7mol/L时可认为沉淀完全,则欲处理IL滤液需要0.1mol/L的Na4[Fe(CN)6]体积为_________ (体积变化忽略不计,保留两位小数)。
(4)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24• 4H2O的盐。蒸发溶液(把氨除去)或中和溶液(化合部分氨)都可以达到这一比例。则操作I为_______ 。

已知:MoO3在869.9K温度下开始升华,而到969.9温度下激烈升华,在溶液中以H2MoO4形式存在
(1)滤渣1的主要成分为
(2)铜钼矿中的钼元素在过量的空气中,于一定温度下,很容易氧化成MoO3,其方程式为
焙烧过程中应控制在800-870K左右,其原因为
(3)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式
②由干氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用深漂白粉或漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;滤液中的Cu2+的浓度为为0.5mol/L、.当溶液中离子浓度小于等于1.00×10-7mol/L时可认为沉淀完全,则欲处理IL滤液需要0.1mol/L的Na4[Fe(CN)6]体积为
(4)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24• 4H2O的盐。蒸发溶液(把氨除去)或中和溶液(化合部分氨)都可以达到这一比例。则操作I为
更新时间:2017-06-10 15:30:27
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】三氧化二钴是重要的化工原料。以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如下图:
的流程如下图:
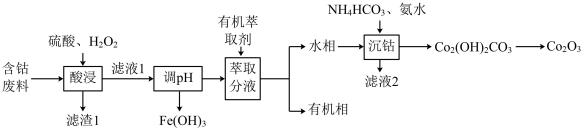
已知:“滤液1”中含有的阳离子有 、
、 、
、 、
、 。
。
(1)“滤渣1”的主要成分是___________ (写化学式)。
(2)“酸浸”时,为了提高钴的浸出率可采取的措施有(写出两种)___________ 。 可将
可将 还原为
还原为 ,离子方程式是
,离子方程式是___________ 。
(3)在工艺流程中,已知 ,调节pH值,要使
,调节pH值,要使 完全沉淀(离子沉淀完全浓度
完全沉淀(离子沉淀完全浓度 ,
, ,请问需要调节pH值为
,请问需要调节pH值为___________ 。
(4)加有机萃取剂的目的是为了除去___________ (填离子符号)。
(5)由“滤液2”可得到的主要副产品是___________ (写化学式)。
(6)“沉钴”过程中,生成 的离子方程式
的离子方程式___________ 。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如下图:
的流程如下图:
已知:“滤液1”中含有的阳离子有
 、
、 、
、 、
、 。
。(1)“滤渣1”的主要成分是
(2)“酸浸”时,为了提高钴的浸出率可采取的措施有(写出两种)
 可将
可将 还原为
还原为 ,离子方程式是
,离子方程式是(3)在工艺流程中,已知
 ,调节pH值,要使
,调节pH值,要使 完全沉淀(离子沉淀完全浓度
完全沉淀(离子沉淀完全浓度 ,
, ,请问需要调节pH值为
,请问需要调节pH值为(4)加有机萃取剂的目的是为了除去
(5)由“滤液2”可得到的主要副产品是
(6)“沉钴”过程中,生成
 的离子方程式
的离子方程式
您最近一年使用:0次
【推荐2】Ⅰ. 某磁铁矿石A的主要成分是磁性氧化铁( ),还含少量的
),还含少量的 、
、 。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知
。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知 不溶于水和碱,但溶于酸:
不溶于水和碱,但溶于酸: )。根据流程回答下列问题:
)。根据流程回答下列问题:
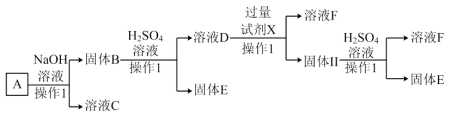
(1)操作Ⅰ涉及的化学反应方程式是_______ 。
(2)在溶液F中加稀硝酸酸化时产生了无色气体,该反应的离子方程式为_______ 。
Ⅱ. 化合物A由四种常见元素组成,是一种重要的化工原料。某实验小组按如图所示流程进行相关实验:
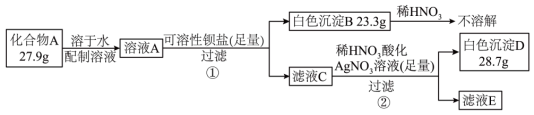
已知化合物A含有两种阴离子和一种阳离子,向溶液A滴加 溶液产生蓝色沉淀。
溶液产生蓝色沉淀。
(3)A的化学式为_______ 。
(4)溶液A中加入稍过量的 溶液,生成沉淀(
溶液,生成沉淀( )的同时有一种气体产生,写出反应的化学方程式:
)的同时有一种气体产生,写出反应的化学方程式:_______ 。
(5)设计实验检验化合物A是否变质,写出检验出化合物A没有变质的方案。_______
 ),还含少量的
),还含少量的 、
、 。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知
。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知 不溶于水和碱,但溶于酸:
不溶于水和碱,但溶于酸: )。根据流程回答下列问题:
)。根据流程回答下列问题:
(1)操作Ⅰ涉及的化学反应方程式是
(2)在溶液F中加稀硝酸酸化时产生了无色气体,该反应的离子方程式为
Ⅱ. 化合物A由四种常见元素组成,是一种重要的化工原料。某实验小组按如图所示流程进行相关实验:

已知化合物A含有两种阴离子和一种阳离子,向溶液A滴加
 溶液产生蓝色沉淀。
溶液产生蓝色沉淀。(3)A的化学式为
(4)溶液A中加入稍过量的
 溶液,生成沉淀(
溶液,生成沉淀( )的同时有一种气体产生,写出反应的化学方程式:
)的同时有一种气体产生,写出反应的化学方程式:(5)设计实验检验化合物A是否变质,写出检验出化合物A没有变质的方案。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】长余辉材料在发光照明、交通等领域具有广泛的应用前景。下图是一种利用大理石(主要成分CaCO3和MgCO3)和铝土矿(主要成分Al2O3,还含少量Fe2O3杂质)制备一种长余辉材料(Ca12Al14Ox)的工艺流程图。回答下列问题:
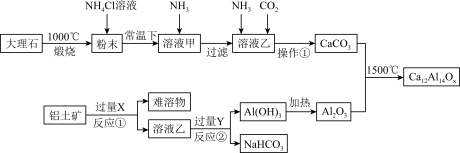
(1)Ca12Al14Ox中x的数值为______ ,试剂X的名称是_________ 。
(2)NH4Cl溶液能溶解“粉末”的原因是_________ ,发生的主要反应的化学方程为______ 。
(3)反应②的离子方程式为_______ 。
(4)实验室加热Al(OH)3应在________ (填仪器名称)进行;操作①包括_____ 、干燥等。
(5)若溶液甲中c(Mg2+) <5×10-5mol•L-1元素损失,此时应调节溶液pH大于______ ,为减少钙元素损失,应控制溶液甲中c(Ca2+)≤______ 。常温下Ksp[Mg(OH)2]=5×10-11,Ksp[Ca(OH)2]=5×10-6。

(1)Ca12Al14Ox中x的数值为
(2)NH4Cl溶液能溶解“粉末”的原因是
(3)反应②的离子方程式为
(4)实验室加热Al(OH)3应在
(5)若溶液甲中c(Mg2+) <5×10-5mol•L-1元素损失,此时应调节溶液pH大于
您最近一年使用:0次
【推荐1】氧化锌在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中应用广泛。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
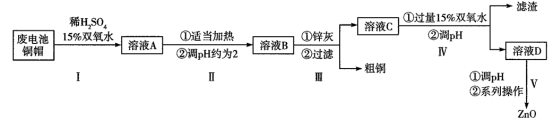
已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、Zn(OH)2均为两性化合物。
(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有___________ (填名称)。
(2)写出第I步中Cu参加反应的离子方程式:___________ 。
(3)假设溶液C中c(Fe2+)=0.01 mol·L-1、c(Zn2+)=1 mol·L-1,常温下,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10-5 mol·L-1时认为沉淀完全):
①上表中的a=___________ (假设第IV步中溶液体积变化忽略不计)。
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因是___________ 。
(4)第V步中“系列操作”指的是过滤、洗涤和煅烧,检验Zn(OH)2沉淀洗涤干净的方法是___________ (写出实验操作、现象和结论)。

已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、Zn(OH)2均为两性化合物。
(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有
(2)写出第I步中Cu参加反应的离子方程式:
(3)假设溶液C中c(Fe2+)=0.01 mol·L-1、c(Zn2+)=1 mol·L-1,常温下,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10-5 mol·L-1时认为沉淀完全):
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 2.3 | 7.3 | 6.2 |
| 沉淀完全的pH | a | 8.8.37 |
①上表中的a=
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因是
(4)第V步中“系列操作”指的是过滤、洗涤和煅烧,检验Zn(OH)2沉淀洗涤干净的方法是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】用含铬不锈钢废渣(含SiO2、Cr2O3、Fe2O3、Al2O3等)制取Cr2O3 (铬绿)的工艺流程如图所示:
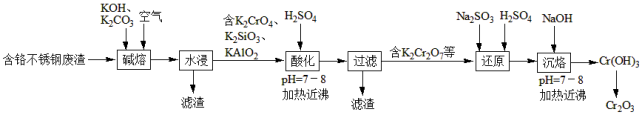
回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是___________ 、___________ 。
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为___________ 。
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物为___________ (填化学式,下同);为检验“水浸”后的滤液中是否含有Fe3+,可选用的化学试剂是___________ 。
(4)常温下,“酸化”时pH不宜过低的原因是___________ ;若此时溶液的pH=8,则c(Al3+)=___________ mol/L。{已知:常温下,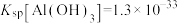 }
}
(5)“还原”时发生反应的离子方程式为___________ 。
(6)“沉铬”时加热近沸的目的是___________ ;由Cr(OH)3制取铬绿的方法是___________ 。

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物为
(4)常温下,“酸化”时pH不宜过低的原因是
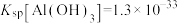 }
}(5)“还原”时发生反应的离子方程式为
(6)“沉铬”时加热近沸的目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
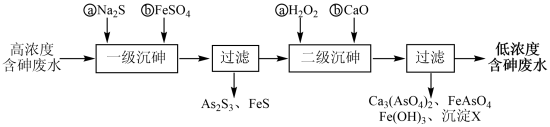
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2 AsS
2 AsS (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为_______ ;砷酸的第一步电离方程式为_______ 。
(2)“一级沉砷”中FeSO4的作用是_______ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______ 。
(3)沉淀X为_______ (填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______ .
(5)步骤2的离子方程式为_______ 。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量_______ (填“符合”、“不符合”)排放标准。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2 AsS
2 AsS (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
(3)沉淀X为
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为
(5)步骤2的离子方程式为
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量
您最近一年使用:0次



