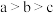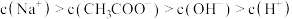常温下,向l0mL0.1mol/L 的HR 溶液中逐渐滴入0.lmol/L 的NH3·H2O 溶液,所得溶液pH 及导电性变化如图。下列分析不正确的是


| A.a~b点导电能力增强,说明HR为弱酸 |
| B.b点溶液c(NH3·H2O)=c(R-)+c(H+)-c(OH-) |
| C.c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+) |
| D.常温下,HR 和NH3·H2O 的电离平衡常数近似相等 |
更新时间:2017-06-10 16:14:20
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】已知:联氨(N2H4)是二元弱碱(pKb1=6,pKb2=15;pK=-lgK),在水中的电离方式类似于氨气,常温下,向0.1mol·L-1N2H5Cl溶液通入HCl或加入NaOH固体(假设溶液总体积不变),溶液中c(N2H )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是

 )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是
A.N2H5Cl溶液c(N2H )>c(N2H4)>c(N2H )>c(N2H4)>c(N2H ) ) |
| B.b点加入NaOH(或HCl)的物质的量与d点加入HCl(或NaOH)物质的量相等 |
| C.水的电离程度:b>a |
D.若c(N2H )>c(N2H4),则pH小于3.5 )>c(N2H4),则pH小于3.5 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向0.1 mol· L-1H3PO4溶液中加入NaOH的过程中各种微粒的物质的量分数(δ)随pH的变化关系如图所示(H3PO4的三级电离常数依次为Ka1、Ka2、Ka3)。下列叙述错误的是
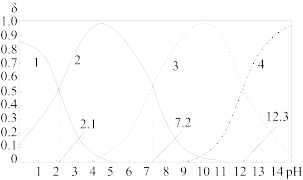

A.Ka2=10-7.2, 的水解平衡常数为10-6.8 的水解平衡常数为10-6.8 |
B.反应 +H2O⇌H3PO4+OH-的K=10-2.1 +H2O⇌H3PO4+OH-的K=10-2.1 |
| C.为获得尽可能纯的NaH2PO4,pH应控制在4~5 |
D.Na2HPO4溶液中存在c(OH-)+c( )=c(H+)+c( )=c(H+)+c( )+2c(H3PO4) )+2c(H3PO4) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】X、Y、Z均为中学化学常见物质,且含有同种元素,它们之间有如下转化关系。则下列说法正确的是


| A.若Y为两性氢氧化物,则a可能是盐酸或氨水 |
B.若X、Y、Z溶液均显碱性,且Z是发酵粉的主要成分之一,则c(Y):c(Z)= 1:1的混合溶液中c( )+2c(OH-)=c( )+2c(OH-)=c(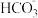 )+2c(H+)+3c(H2CO3) )+2c(H+)+3c(H2CO3) |
| C.若X为Cl2,且a为用量最大的金属,则将Z溶液蒸干可得到纯净的Z |
| D.若Z是形成酸雨的主要物质,则X与Z反应生成的氧化产物与还原产物质量之比为1:2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25 ℃时,0.1 mol/LR2SO4溶液加水稀释,混合溶液中 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
| A.Kb(ROH)的数量级为10-6 |
| B.P、Q点对应溶液中c(H+ )的值:P<Q |
C.若将溶液无限稀释,溶液中c(R+ )≈2c(SO ) ) |
| D.相同条件下,若改为c(R2SO4)=0.2 mol/L,P点移至W点 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】下列有关实验现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将氯化铁溶液加热灼烧 | 有固体析出 | 该固体是氯化铁 |
| B | 氯化铜溶液中有氯化铁杂质,加入氧化铜除杂 | 有红褐色物质析出 | 调节pH使铁离子水解平衡右移 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4的 N2O4的 H>0 H>0 |
| D | 向1 mL 0.l mol/L的AgNO3溶液中加入4滴0.1 mol/L的NaCl溶液,再加10滴0.1 mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

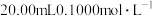 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中,
溶液,溶液中,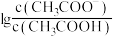 随
随 的变化关系如图所示(取
的变化关系如图所示(取 )。
)。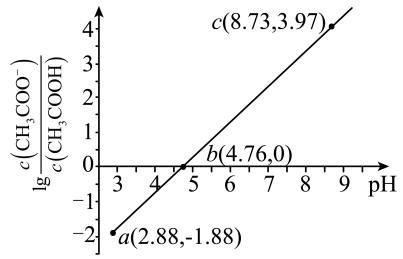

 时,消耗
时,消耗