下列叙述正确的是
| A.两种难溶性盐,Ksp较小的,其溶解度也一定较小 |
| B.稀释氨水溶液,溶液中所有离子的浓度都降低 |
| C.稀释醋酸钠溶液,CH3COO- 水解程度变大,故溶液的pH增大 |
| D.相同条件下,HA比HB易电离,则NaA溶液的pH比NaB溶液的pH小 |
更新时间:2017-07-13 06:46:41
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】20℃时H2S饱和溶液1L,其浓度为0.1mol/L,若要使溶液的pH和c(S2-)减小,可采取的措施是
| A.通入适量的H2S气体 | B.加入少量的氢氧化钠固体 |
| C.加入适量的CuSO4固体 | D.加入适量水 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离程度减小 ②c(NH3·H2O)减小 ③NH4+数目增多 ④由水电离出的c(OH-)增大 ⑤导电性增强 ⑥ c(NH4+)/c(NH3∙H2O)增大
①电离程度减小 ②c(NH3·H2O)减小 ③NH4+数目增多 ④由水电离出的c(OH-)增大 ⑤导电性增强 ⑥ c(NH4+)/c(NH3∙H2O)增大
| A.①②③④ | B.②③④⑤ | C.①③⑤⑥ | D.②③④⑥ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】某溶液中只含有四种离子,已知其中三种离子Na +,Ca2 +,NO3-的物质的量浓度分别是2mol/L、1mol/L、1mol/L,则溶液中另一离子及其物质的量浓度是( )
| A.CO32 1.5mol/L | B.K+ 0.5mol/L |
| C.OH- 3mol/L | D.Cl 2mol/L |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】溶液X可能含有如下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 、
、 ,为确定其成分,某同学设计并进行了如下实验(假设气体全部逸出):
,为确定其成分,某同学设计并进行了如下实验(假设气体全部逸出):
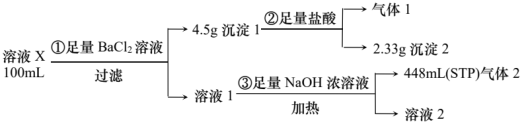
下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 ,为确定其成分,某同学设计并进行了如下实验(假设气体全部逸出):
,为确定其成分,某同学设计并进行了如下实验(假设气体全部逸出):
下列说法错误的是
A.溶液X中一定不存在 、 、 和 和 |
B.沉淀1的成分是等物质的量的 和 和 |
C.溶液X中一定存在 ,且 ,且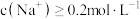 |
D.实验③发生反应的离子方程式为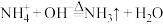 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】已知25℃时,部分弱电解质的电离平衡常数如表:
下列离子方程式或守恒关系正确的是
| 弱电解质 | HClO | H2CO3 | H2SO3 | NH3·H2O |
| 电离平衡常数 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.5×10-2 Ka2=6.0×10-8 | Kb=1.75×10-5 |
A.将Cl2通入到过量Na2CO3溶液中:Cl2+H2O+CO =HCO =HCO +HClO+Cl- +HClO+Cl- |
B.将SO2通入到NaClO溶液中:ClO-+H2O+SO2=HClO+HSO |
C.向亚硫酸溶液中加入氨水至中性:c(NH )=c(SO )=c(SO )+c(H2SO3)+c(HSO )+c(H2SO3)+c(HSO ) ) |
D.向过量Na2CO3溶液中通入少量SO2:SO2+H2O+2CO =2HCO =2HCO +SO +SO |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 在少量浓硝酸中加入大量铁屑,充分反应后滴加 KSCN 溶液 | 后来溶液无血红色 | Fe 被氧化为 Fe2+ |
| B | 少量 Zn 粉加到 1.0mol·L-1Fe2(SO4)3 溶液中 | 溶液颜色变浅 | 金属 Zn 比 Fe 活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 无液态铝滴落下来 | 金属铝的熔点较高 |
| D | 向浓度均为 0.1mol·L-1 的 CuSO4 和 MgSO4 混合溶液中滴加少量NaOH 溶液 | 只出现浅蓝色沉淀 | Cu(OH)2 的溶度积比Mg(OH)2 的小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列实验操作、现象和得出的结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向25 mL冷水与沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
| C | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3⋅H2O能大量共存 |
| D | 向饱和Na2CO3溶液中加入BaSO4固体,振荡、过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)>Ksp(BaSO4) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列根据实验操作和现象和所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1 mol·L-1NaCl和NaI的混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入盐酸酸化的Ba(NO3)2溶液 | 出现白色沉淀 | 该溶液一定有SO42-或Ag+ |
| D | 向淀粉水解液中加入新制Cu(OH)2,煮沸 | 没有生成砖红色沉淀 | 淀粉未水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 )与n(NH3•H2O)之和始终为0.1mol
)与n(NH3•H2O)之和始终为0.1mol

