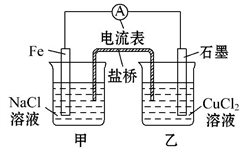
(1)如图为某实验小组依据氧化还原反应(用离子方程式表示)________ 设计的原电池装置。反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________ mol电子。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:__________ 。
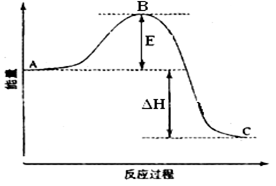
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点_________ (填“升高”还是“降低”),△H______ (填“变大”、“变小”或“不变”)。

(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点

更新时间:2017-11-17 21:52:42
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】磷能形成多种含氧酸,请回答下列问题:
(1)工业上常用磷精矿[ ]与硫酸反应制备磷酸。已知25℃,101kPa时。
]与硫酸反应制备磷酸。已知25℃,101kPa时。

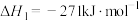
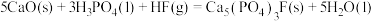

则 与硫酸反应生成磷酸的热化学方程式为
与硫酸反应生成磷酸的热化学方程式为___________ 。
(2)次磷酸( )是一种精细化工产品,向
)是一种精细化工产品,向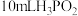 溶液中加入30mL等物质的量浓度的NaOH溶液后,所得到的溶液中只有
溶液中加入30mL等物质的量浓度的NaOH溶液后,所得到的溶液中只有 、
、 两种阴离子。
两种阴离子。
①写出 溶液与足量NaOH溶液反应后所形成的正盐的化学式:
溶液与足量NaOH溶液反应后所形成的正盐的化学式:___________ 。
②常温下, 的
的 溶液在加水稀释过程中,下列表达式的数值一定减小的是
溶液在加水稀释过程中,下列表达式的数值一定减小的是___________ (填字母)。
A. B.
B. C.
C.
(3)亚磷酸( )是二元中强酸,25℃时其电离常数为
)是二元中强酸,25℃时其电离常数为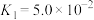 、
、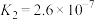 。
。
①试从电离平衡移动的角度解释 、
、 数据的差异:
数据的差异:___________ 。
② 是
是___________ (填“酸式盐”“碱式盐”或“正盐”)。
(4)已知25℃时,HF的电离常数为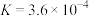 ;
; 的电离常数为
的电离常数为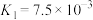 ,
,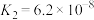 ,
,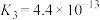 。
。
①足量NaF溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
②已知:
 ,则
,则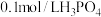 溶液与足量0.1mol/LNaOH溶液反应生成
溶液与足量0.1mol/LNaOH溶液反应生成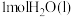 放出的热量
放出的热量___________ (填字母)。
A.等于57.3kJ B.小于57.3kJ C.大于57.3kJ D.无法确定
(1)工业上常用磷精矿[
 ]与硫酸反应制备磷酸。已知25℃,101kPa时。
]与硫酸反应制备磷酸。已知25℃,101kPa时。
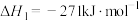
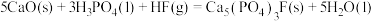

则
 与硫酸反应生成磷酸的热化学方程式为
与硫酸反应生成磷酸的热化学方程式为(2)次磷酸(
 )是一种精细化工产品,向
)是一种精细化工产品,向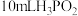 溶液中加入30mL等物质的量浓度的NaOH溶液后,所得到的溶液中只有
溶液中加入30mL等物质的量浓度的NaOH溶液后,所得到的溶液中只有 、
、 两种阴离子。
两种阴离子。①写出
 溶液与足量NaOH溶液反应后所形成的正盐的化学式:
溶液与足量NaOH溶液反应后所形成的正盐的化学式:②常温下,
 的
的 溶液在加水稀释过程中,下列表达式的数值一定减小的是
溶液在加水稀释过程中,下列表达式的数值一定减小的是A.
 B.
B. C.
C.
(3)亚磷酸(
 )是二元中强酸,25℃时其电离常数为
)是二元中强酸,25℃时其电离常数为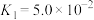 、
、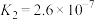 。
。①试从电离平衡移动的角度解释
 、
、 数据的差异:
数据的差异:②
 是
是(4)已知25℃时,HF的电离常数为
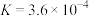 ;
; 的电离常数为
的电离常数为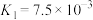 ,
,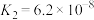 ,
,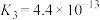 。
。①足量NaF溶液与
 溶液反应的离子方程式为
溶液反应的离子方程式为②已知:

 ,则
,则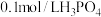 溶液与足量0.1mol/LNaOH溶液反应生成
溶液与足量0.1mol/LNaOH溶液反应生成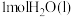 放出的热量
放出的热量A.等于57.3kJ B.小于57.3kJ C.大于57.3kJ D.无法确定
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式________ 。
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。
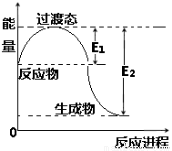
若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________ 、________ (填“增大”、“减小”或“不变”);该反应放出的热量为__________ kJ。
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH____________ 0 (填“大于”、“ 小于”或“大于或小于都可”)。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。

若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的电子式是___________ 。
(2)该反应的热化学方程式为___________ 。
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为___________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
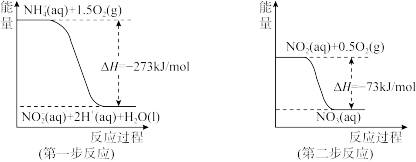
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是___________ 。
(5)已知: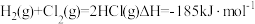 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=___________ 。
(1)过氧化氢的电子式是
(2)该反应的热化学方程式为
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是(5)已知:
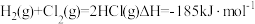 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=| 共价键 | H-H | Cl-Cl | H-Cl |
键能/( ) ) | 436 | 247 | a |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】自科学家们开始研究物质的结构与性质以来,氢元素时常担任主角,例如氢原子光谱启发了人们对原子结构的探索。此外,氢气与氢能源也是时下热门的一种绿色能源。氢能是最具发展潜力的清洁能源,但当下的生产条件非常苛刻且纯度不高。因此,科学家们正在寻找更经济、环境友好的方法,电解水便是其中一种。
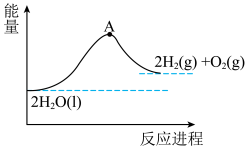
(1)已知在298K和100kPa的条件下,液态水分解生成氢气: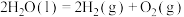
 。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如
。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如 ,那么图中A点将
,那么图中A点将___________ (填“升高”、“降低”或“不变”)。
(2)部分化学键的键能和反应焓变的数据如下:
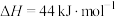 ,
, ,
,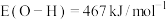 ,
,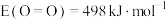 ,由此可计算得上述反应的
,由此可计算得上述反应的 为
为___________ 。又知该反应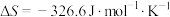 ,那么该反应在298K条件下能否自发进行?
,那么该反应在298K条件下能否自发进行?___________ 。
(3)试从绿色化学的角度比较并评价直接电解海水与太阳能( 作催化剂)分解淡水两种制备氢气的方案
作催化剂)分解淡水两种制备氢气的方案___________ 。
(1)已知在298K和100kPa的条件下,液态水分解生成氢气:
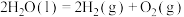
 。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如
。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如 ,那么图中A点将
,那么图中A点将
(2)部分化学键的键能和反应焓变的数据如下:

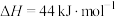 ,
, ,
,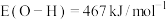 ,
,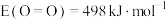 ,由此可计算得上述反应的
,由此可计算得上述反应的 为
为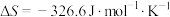 ,那么该反应在298K条件下能否自发进行?
,那么该反应在298K条件下能否自发进行?(3)试从绿色化学的角度比较并评价直接电解海水与太阳能(
 作催化剂)分解淡水两种制备氢气的方案
作催化剂)分解淡水两种制备氢气的方案
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(1)已知:H2O(l)=H2O(g) △H=+44.0kJ•mol-1,甲烷完全燃烧与不完全燃烧的热效应如图所示。
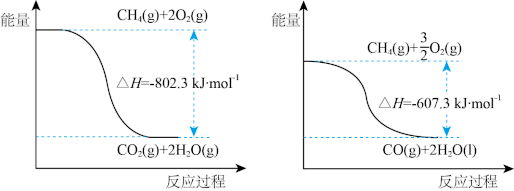
CO的燃烧热△H=_____ kJ•mol-1。
(2)已知拆开1molH-H、1molN-H、1molN≡N化学键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______ 。
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如图。

①第二步反应的△H_____ 0(填“>”、“<”或“=”)。
②从图像分析决定生产尿素的总反应的反应速率的步骤是第_____ 步反应。
(4)实验室用50mL0.50mol•L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。

①该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为_____ 。
②下列关于实验和中和反应的说法正确的是_____ (填序号)。
A.本实验中,读取混合溶液不再变化的温度为终止温度
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25℃、101kPa下,强酸和强碱的稀溶液发生中和反应生成1molH2O时,放出57.3kJ•mol-1的热量
(1)已知:H2O(l)=H2O(g) △H=+44.0kJ•mol-1,甲烷完全燃烧与不完全燃烧的热效应如图所示。

CO的燃烧热△H=
(2)已知拆开1molH-H、1molN-H、1molN≡N化学键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如图。

①第二步反应的△H
②从图像分析决定生产尿素的总反应的反应速率的步骤是第
(4)实验室用50mL0.50mol•L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。

①该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为
②下列关于实验和中和反应的说法正确的是
A.本实验中,读取混合溶液不再变化的温度为终止温度
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25℃、101kPa下,强酸和强碱的稀溶液发生中和反应生成1molH2O时,放出57.3kJ•mol-1的热量
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是___________ 。
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐( )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
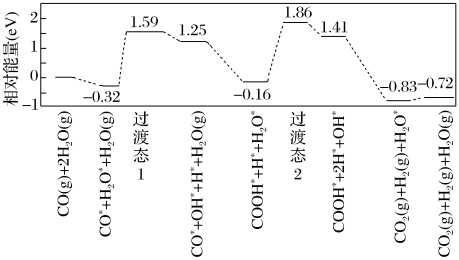
体积比为___________ 。___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐(
 )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为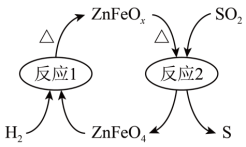
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_____________ 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极__________ ,并写出电极反应式。正极反应__________ ,负极反应____________ 。若用此电池向外电路输送0.5mol电子,负极质量_______ (填增重或减轻)____ 克。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
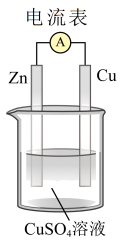
【推荐2】化学能在一定条件下可转化为电能。
(1)如图装置中,Zn片发生___________ 反应(填“氧化”或“还原”),Cu片上发生反应的电极反应式为___________ ,能证明化学能转化为电能的实验现象是___________ 。
(2)下列反应通过原电池装置,可将化学能转化为电能的是___________ (填字母)。
a. b.
b. c.
c.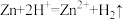
(3)某镁-海水电池工作原理如图所示,其总反应为: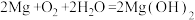 。下列说法正确的是
。下列说法正确的是___________ 。(填字母)
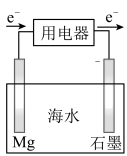
a.Mg作电池的正极 b.O2发生还原反应
(1)如图装置中,Zn片发生

(2)下列反应通过原电池装置,可将化学能转化为电能的是
a.
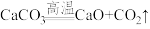 b.
b. c.
c.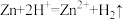
(3)某镁-海水电池工作原理如图所示,其总反应为:
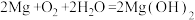 。下列说法正确的是
。下列说法正确的是
a.Mg作电池的正极 b.O2发生还原反应
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的重大贡献。
(1)将纯锌片和纯铜片按图甲、图乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:______ ,该烧杯中铜片上的现象为______ 。
②在相同时间内,两烧杯中产生气泡的速度:甲______ 乙(填“>”“<”或“=”)。
③形成原电池的装置中电子移动的方向是:流向______ (写电极材料的名称)
④当甲中溶液质量增重31.5g时,电极上转移电子数目为______ 。
(2)燃料电池是一种高效、环境友好的发电装置,图丁为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的为电池的______ (填“正极”或“负极”),写出负极电极反应式______ 。
(1)将纯锌片和纯铜片按图甲、图乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
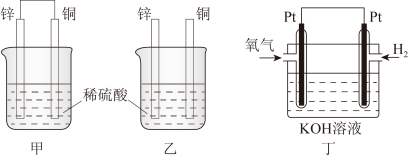
②在相同时间内,两烧杯中产生气泡的速度:甲
③形成原电池的装置中电子移动的方向是:流向
④当甲中溶液质量增重31.5g时,电极上转移电子数目为
(2)燃料电池是一种高效、环境友好的发电装置,图丁为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的为电池的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】存在于生活污水中的有机物极不稳定,容易腐化而产生恶臭。细菌和病原体以生活污水中的有机物为营养而大量繁殖,可导致传染病蔓延流行。因此,生活污水排放前必须进行处理。最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。回答下列问题:

(1)氧化银电极上的反应为_________ 。
(2)石墨电极上的反应为________ 。
(3)每转移4mol电子,氧化银电极产生_________ LCO2气体(标准状况)。
(4)每30gC6H12O6参与反应,有______ molH+经质子交换膜进入正极区。

(1)氧化银电极上的反应为
(2)石墨电极上的反应为
(3)每转移4mol电子,氧化银电极产生
(4)每30gC6H12O6参与反应,有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】利用电化学原理,将 、
、 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 废水,如下图所示;电解过程中溶液发生反应:
废水,如下图所示;电解过程中溶液发生反应:

(1)甲池工作时, 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨Ⅱ是电池的
,可循环使用。则石墨Ⅱ是电池的_____ 极;石墨Ⅰ附近发生的电极反应式为___________ 。
(2)工作时,甲池内的 离子向
离子向___________ 极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的 和
和 的体积比为
的体积比为___________ 。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为___________ 。
 、
、 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 废水,如下图所示;电解过程中溶液发生反应:
废水,如下图所示;电解过程中溶液发生反应:

(1)甲池工作时,
 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨Ⅱ是电池的
,可循环使用。则石墨Ⅱ是电池的(2)工作时,甲池内的
 离子向
离子向 和
和 的体积比为
的体积比为(3)乙池中Fe(Ⅰ)棒上发生的电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.如图为原电池装置示意图。

(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,写出B电极反应式:__ 。该电池在工作时,A电极的质量将___ (填“增加”“减小”或“不变”),若该电池反应消耗了0.1molH2SO4,则转移电子的数目为__ 。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:___ 。该电池在工作一段时间后,溶液的碱性将___ (填“增强”“减弱”或“不变”)。

(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,写出B电极反应式:
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:
您最近一年使用:0次



