氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.两种分子均是sp3杂化,NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
12-13高二上·辽宁丹东·期末 查看更多[2]
更新时间:2018-02-01 17:20:11
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列分子中,键角最小的是( )
| A.CO2 | B.BF3 | C.NH3 | D.H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关Cl-、ClO-、ClO 、ClO
、ClO 和ClO
和ClO 的说法
的说法不正确 的是
 、ClO
、ClO 和ClO
和ClO 的说法
的说法A.随Cl元素化合价升高,Cl-、ClO-、ClO 、ClO 、ClO 和ClO 和ClO 的氧化性增强 的氧化性增强 |
B.ClO 、ClO 、ClO 和ClO 和ClO 中心原子轨道的杂化类型均为sp3 中心原子轨道的杂化类型均为sp3 |
C.Cl-可提供孤电子对与CuCl形成CuCl |
D.ClO 的空间构型为三角锥形 的空间构型为三角锥形 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】X、Y、Z、W、Q五种短周期主族元素,原子序数依次增大。Z的核电荷数等于X、Y原子核外电子数之和,W与X同主族且其核外电子空间运动状态有6种,Y元素的最高价氧化物对应水化物能与其氢化物水溶液发生反应,YX3气体分子的Y原子采用sp3杂化,Q是同周期主族元素中原子半径最小的元素。下列说法正确的是
| A.X与Y不能形成具有18电子的分子 |
| B.简单离子的半径大小:Q>Z>W |
| C.最高价氧化物对应水化物的酸性:Y>Q |
D.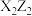 和 和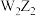 中含有的化学键类型相同 中含有的化学键类型相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某物质结构如图所示,其中X、Y、Z、M、W均为短周期主族元素,且原子序数依次增大。下列说法正确的是


| A.基态 X原子核外有5种运动状态不同的电子 |
B.第一电离能: |
C.该化合物中X和Y原子均为 杂化 杂化 |
D.原子半径: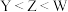 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种含“水”矿物Ca5(PO4)3(OH)。下列化学用语或图示表达错误的是
A.—OH的电子式: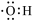 |
B. 的结构示意图: 的结构示意图: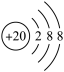 |
C.H2O中O原子的杂化轨道类型为 |
D. 的空间结构为正四面体形 的空间结构为正四面体形 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】根据如图所示的反应判断,下列说法中错误的是


| A.该反应是一个吸热反应 |
B. 和 和 中碳原子的杂化类型相同 中碳原子的杂化类型相同 |
| C.该反应中既有离子键断裂,又有共价键断裂 |
D. 的分子立体构型是直线形 的分子立体构型是直线形 |
您最近一年使用:0次

 )具有很强的还原性,
)具有很强的还原性,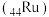 表面与水反应的历程如图所示。下列说法错误的是
表面与水反应的历程如图所示。下列说法错误的是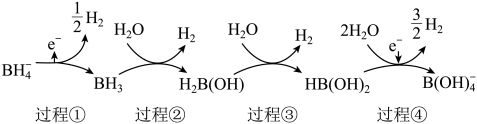
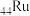 )位于元素周期表的VIII族
)位于元素周期表的VIII族 能级上轨道表示式为
能级上轨道表示式为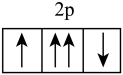
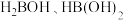 和
和 中B的
中B的 模型相同
模型相同



 )中
)中


