有关物质的转化关系如图所示(反应条件及部分产物已略去)。A、C、D 中均含有相同的非金属元素,C、G 为气体,D 为淡黄色单质,I为常见强酸,反应③为化合反应。J溶液与KSCN 溶液混合呈血红色。A 中仅含两种元素,且元素质量比为7:8。

请回答下列问题:
(1)A的化学式为__________ 。
(2)H的电子式为__________ 。
(3)写出①的离子方程式为__________ 。
(4)写出②的化学方程式为____________ 并用单线桥标出电子转移方向和数目。

请回答下列问题:
(1)A的化学式为
(2)H的电子式为
(3)写出①的离子方程式为
(4)写出②的化学方程式为
更新时间:2018-03-18 16:29:43
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O及少量氧化铁.利用明矾石制备K2SO4的工艺流程如下所示:

(1)焙烧炉中发生如下反应,请在方程式中表示出电子转移的方向和数目:________
2Al2(SO4)3+3S 2Al2O3+9SO2↑
2Al2O3+9SO2↑
(2)步骤②涉及Al2O3的离子方程式为________ ;
(3)步骤③调pH生成Al OH)3的离子方程式为________ ;不能用CO2来调pH,理由是________ ;
(4)步骤④的主要操作步骤是________ 、过滤、洗涤和干燥;
(5)炉气回收可以有很多用途,举例说明其中一种:________ 。

(1)焙烧炉中发生如下反应,请在方程式中表示出电子转移的方向和数目:
2Al2(SO4)3+3S
 2Al2O3+9SO2↑
2Al2O3+9SO2↑(2)步骤②涉及Al2O3的离子方程式为
(3)步骤③调pH生成Al OH)3的离子方程式为
(4)步骤④的主要操作步骤是
(5)炉气回收可以有很多用途,举例说明其中一种:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】铜是不活泼的金属,常见有 、
、 价。为探究铜及其化合物的性质,完成了两组实验,部分记录如下:
价。为探究铜及其化合物的性质,完成了两组实验,部分记录如下:
第一组:
完成下列填空:
(1)写出试管1中发生反应的离子方程式。___________
(2)试管2,预测步骤ⅱ后溶液不应呈红色,依据是___________ 。
(3)经测定试管2中得到的白色沉淀是 。
。
对生成 有两种猜测:
有两种猜测:
猜测① 和
和 反应生成
反应生成 ,根据
,根据___________ ,推知这一猜测错误。
猜测②生成白色沉淀是因为:Cu++SCN-=CuSCN↓。再请结合步骤ⅱ溶液出现红色的现象,解释生成沉淀的可能原因。___________ (用离子方程式表示)
第二组:水合肼(N2H4·H2O)和碱性铜氨[Cu(NH3)4]2+溶液混合反应,生成铜。
(4)水合肼溶液显弱碱性,其电离与NH3·H2O相似,写出水合肼的电离方程式:___________ 。
(5)将下列化学方程式补充完整、配平,并标出电子转移的数目和方向___________ 。
______N2H4·H2O+_____[Cu(NH3)4]2++_____OH-→_____Cu+_______N2↑+_______NH3+____H2O
(6)水合肼可用于还原锅炉水中溶解的O2,防止锅炉被腐蚀。与Na2SO3相比,使用水合肼处理水中溶解O2的优点是___________ (任写一点)。
 、
、 价。为探究铜及其化合物的性质,完成了两组实验,部分记录如下:
价。为探究铜及其化合物的性质,完成了两组实验,部分记录如下:第一组:
| 序号 | 试剂 | 实验步骤 | 实验现象 |
| 1 | 试管1中加2mL0.05mol·L-1Fe2(SO4)3溶液 | 加入1mL0.1mol·L-1KSCN溶液 | 溶液变为红色 |
| 2 | 试管2中加2mL0.05mol·L-1Fe2(SO4)3溶液 | ⅰ加入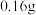 铜粉 铜粉 | 黄色溶液变为浅蓝色溶液 |
| ⅱ取上层清液,加入1滴0.1mol·L-1KSCN溶液 | 液滴接触上方变为红色,下方有白色沉淀生成 | ||
| 3 | 试管3中加2mL0.1mol·L-1 CuSO4溶液 | 加入1mL0.1mol·L-1KSCN溶液 | 溶液变成绿色 |
(1)写出试管1中发生反应的离子方程式。
(2)试管2,预测步骤ⅱ后溶液不应呈红色,依据是
(3)经测定试管2中得到的白色沉淀是
 。
。对生成
 有两种猜测:
有两种猜测:猜测①
 和
和 反应生成
反应生成 ,根据
,根据猜测②生成白色沉淀是因为:Cu++SCN-=CuSCN↓。再请结合步骤ⅱ溶液出现红色的现象,解释生成沉淀的可能原因。
第二组:水合肼(N2H4·H2O)和碱性铜氨[Cu(NH3)4]2+溶液混合反应,生成铜。
(4)水合肼溶液显弱碱性,其电离与NH3·H2O相似,写出水合肼的电离方程式:
(5)将下列化学方程式补充完整、配平,并标出电子转移的数目和方向
______N2H4·H2O+_____[Cu(NH3)4]2++_____OH-→_____Cu+_______N2↑+_______NH3+____H2O
(6)水合肼可用于还原锅炉水中溶解的O2,防止锅炉被腐蚀。与Na2SO3相比,使用水合肼处理水中溶解O2的优点是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】工业上由黄铜矿(主要成分为 )冶炼铜和制备硫酸的生产流程如图所示:
)冶炼铜和制备硫酸的生产流程如图所示:
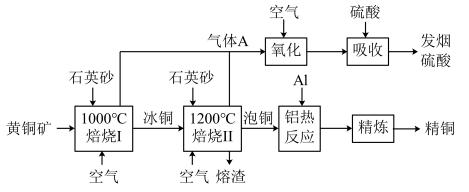
已知:冰铜主要成分是 、
、 ,泡铜主要成分是
,泡铜主要成分是 、
、 。
。
回答下列问题:
(1)提高黄铜矿焙烧利用率的措施有_______ (答两条)。
(2)“焙烧Ⅱ”被称为“火法炼铜”, 转化为
转化为 ,
, 继续与
继续与 反应生成
反应生成 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)“铝热反应”的化学方程式为 ,用双线桥法表示出该反应的电子转移情况:
,用双线桥法表示出该反应的电子转移情况:_______ 。
(4)写出“氧化”步骤发生反应的化学方程式:_______ 。
(5)某发烟硫酸中含 和
和 分子的个数比为
分子的个数比为 ,
,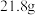 该发烟硫酸中加入
该发烟硫酸中加入_______ g水可转化成98%的浓硫酸。
 )冶炼铜和制备硫酸的生产流程如图所示:
)冶炼铜和制备硫酸的生产流程如图所示:
已知:冰铜主要成分是
 、
、 ,泡铜主要成分是
,泡铜主要成分是 、
、 。
。回答下列问题:
(1)提高黄铜矿焙烧利用率的措施有
(2)“焙烧Ⅱ”被称为“火法炼铜”,
 转化为
转化为 ,
, 继续与
继续与 反应生成
反应生成 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:(3)“铝热反应”的化学方程式为
 ,用双线桥法表示出该反应的电子转移情况:
,用双线桥法表示出该反应的电子转移情况:(4)写出“氧化”步骤发生反应的化学方程式:
(5)某发烟硫酸中含
 和
和 分子的个数比为
分子的个数比为 ,
,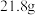 该发烟硫酸中加入
该发烟硫酸中加入
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】现有中学化学常见的金属单质A、B、C和气体甲、乙、丙、丁以及物质D、E、F、G、H、X,其中气体乙为黄绿色气体,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
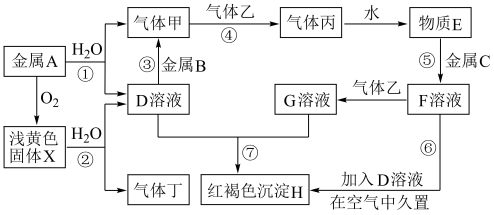
请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:___________ 。
(2)写出反应②的化学方程式:___________ ,该反应的氧化剂是_____ 。
(3)写出反应③的化学方程式:___________ 。
(4)写出反应⑥的化学方程式:___________ 。

请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:
(2)写出反应②的化学方程式:
(3)写出反应③的化学方程式:
(4)写出反应⑥的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,
它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素,C是当今产量和用量最多的金属。请回答下列问题:

(1)写出金属B和气体丙的化学式______________ 、 ____________ 。
(2)写出反应①的化学反应方程式________________________________________ 。
(3)沉淀H的化学式为_______________ 。
(4)往溶液G中滴入KSCN溶液,现象是_________________________
它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素,C是当今产量和用量最多的金属。请回答下列问题:

(1)写出金属B和气体丙的化学式
(2)写出反应①的化学反应方程式
(3)沉淀H的化学式为
(4)往溶液G中滴入KSCN溶液,现象是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】碳酸亚铁( )是生产补血剂的重要原料,制取
)是生产补血剂的重要原料,制取 过程中涉及以下实验。
过程中涉及以下实验。
实验一:为探究某固体化合物X(仅含有三种元素)的组成和性质,设计并完成如下实验

已知:气体甲、气体乙均为短周期元素的单质。
请回答:
(1)化合物X含有的元素为___________ (写元素符号),化合物A的化学式为___________ 。写出A溶于足量稀硝酸的化学反应方程式为___________ 。
实验二:如图装置利用实验一所得溶液B制取 (白色固体,难溶于水):
(白色固体,难溶于水):

装置丙中,先将导管移出液面通入一段时间气体,再向 溶液(
溶液( )通入一段时间
)通入一段时间 至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到
至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到 固体。请回答:
固体。请回答:
(2)丙装置的反应仪器名称是___________ 。试剂a是___________ 。
(3)向 溶液通入
溶液通入 的目的是
的目的是___________ 。
(4)常温下,向 溶液(
溶液( )通入一段时间
)通入一段时间 至
至 时溶液中
时溶液中
___________ (已知 的
的 ,
, )。
)。
(5)丙装置中制取 的离子方程式为
的离子方程式为___________ 。
(6)检验溶液B中的金属阳离子可选用下列哪些试剂___________。
(7)100mL0.8mol/LB溶液完全反应,最终得到8.2克 固体,则产率为
固体,则产率为___________ (结果保留2位小数)。
 )是生产补血剂的重要原料,制取
)是生产补血剂的重要原料,制取 过程中涉及以下实验。
过程中涉及以下实验。实验一:为探究某固体化合物X(仅含有三种元素)的组成和性质,设计并完成如下实验

已知:气体甲、气体乙均为短周期元素的单质。
请回答:
(1)化合物X含有的元素为
实验二:如图装置利用实验一所得溶液B制取
 (白色固体,难溶于水):
(白色固体,难溶于水):
装置丙中,先将导管移出液面通入一段时间气体,再向
 溶液(
溶液( )通入一段时间
)通入一段时间 至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到
至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到 固体。请回答:
固体。请回答:(2)丙装置的反应仪器名称是
(3)向
 溶液通入
溶液通入 的目的是
的目的是(4)常温下,向
 溶液(
溶液( )通入一段时间
)通入一段时间 至
至 时溶液中
时溶液中
 的
的 ,
, )。
)。(5)丙装置中制取
 的离子方程式为
的离子方程式为(6)检验溶液B中的金属阳离子可选用下列哪些试剂___________。
| A.酸性高锰酸钾溶液 | B.NaOH |
C.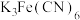 | D.KSCN |
 固体,则产率为
固体,则产率为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】根据图中的实验现象及转化关系判断:

(1)A、B、C、D、E、F、G各是什么物质___ 、___ 、___ 、___ 、___ 、___ 、___ 。
(2)写出①、②反应的离子方程式___ 、___ 。③、④反应的化学方程式___ 、___ 。

(1)A、B、C、D、E、F、G各是什么物质
(2)写出①、②反应的离子方程式
您最近一年使用:0次
【推荐2】X是由四种短周期元素组成的纯净物,合结晶水,相对分子量范围: 105~230,它是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂,现将X按如图流程实验,气体A到气体B质量减轻7.2 g。气体B能使品红溶液褪色,固体B中含两种固体(两种固体所含元素相同),溶液D焰色反应呈黄色。(气体体积均为标况下体积)。
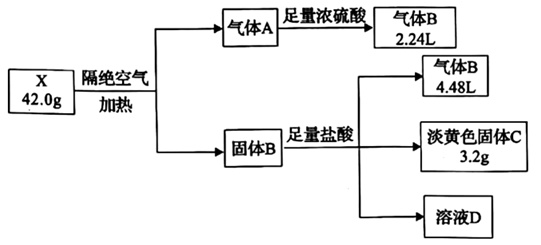
(1)X中含有的非金属元素有_______ (填写元素符号)。
(2)写出x隔绝空气加热的化学方程式_______ 。
(3)X溶液暴露于空气中易吸收氧气而被氧化成一种酸式盐,请写出离子方程式_______ 。
(4)关于气体B使品红水溶液褪色的原因,一般认为B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明_______ 。

(1)X中含有的非金属元素有
(2)写出x隔绝空气加热的化学方程式
(3)X溶液暴露于空气中易吸收氧气而被氧化成一种酸式盐,请写出离子方程式
(4)关于气体B使品红水溶液褪色的原因,一般认为B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】化合物X(仅含两种元素)可通过淡黄色固体单质甲与 浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。
浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。

已知:气体乙在标准状况下的密度为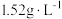 ;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
请回答:
(1)写出组成X的元素符号_______ ,乙的电子式_______ 。
(2)X与足量盐酸反应的化学方程式为_______ 。
(3)气体丙与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(4)请设计实验方案检验溶液丁中的金属阳离子_______ 。
 浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。
浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。
已知:气体乙在标准状况下的密度为
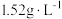 ;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。请回答:
(1)写出组成X的元素符号
(2)X与足量盐酸反应的化学方程式为
(3)气体丙与
 溶液反应的离子方程式为
溶液反应的离子方程式为(4)请设计实验方案检验溶液丁中的金属阳离子
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
真题
名校
【推荐1】某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是______________ 。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案_____________________ 。
(3)蒸馏装置如下图所示,装置中存在的错误是_______________________________ 。

(4)滴定前,加入的适量溶液B是_________ 。
A.H2SO3—H3PO4 B.H2SO4—H3PO4
C.HNO3—H3PO4 D.HI—H3PO4
(5)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00mL。根据该实验数据,试样X中c(Fe3+)为____________ 。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______ 。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案
(3)蒸馏装置如下图所示,装置中存在的错误是

(4)滴定前,加入的适量溶液B是
A.H2SO3—H3PO4 B.H2SO4—H3PO4
C.HNO3—H3PO4 D.HI—H3PO4
(5)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00mL。根据该实验数据,试样X中c(Fe3+)为
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】在下图所示的转化关系中,A~J分别表示中学化学中常见的一种物质,其中部分反应物、生成物没有列出。已知反应③是一种重要的工业生产原理,A、B、C、D、E、F六种物质中含有同一种元素。请回答下列问题:
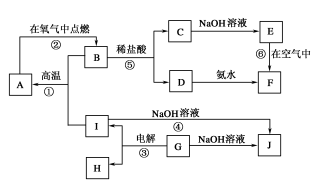
(1)I、G、J三种物质中所含同一种元素在周期表中的位置是_______ 。
(2)写出反应④的离子方程式_________ 。
(3)写出反应⑥的化学方程式_________ 。
(4)写出反应③的电极反应式:阳极:______ ;阴极:______ 。
(5)从能量变化的角度看,①②③④反应中焓变ΔH<0的反应是_____ 。(填序号)
(6)A、B、C、D、E、F六种物质中所含同一种元素的电子排布式________ 。

(1)I、G、J三种物质中所含同一种元素在周期表中的位置是
(2)写出反应④的离子方程式
(3)写出反应⑥的化学方程式
(4)写出反应③的电极反应式:阳极:
(5)从能量变化的角度看,①②③④反应中焓变ΔH<0的反应是
(6)A、B、C、D、E、F六种物质中所含同一种元素的电子排布式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成及含量,他们进行如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有___________ ;
(2)用以下装置可以说明产物有Fe3O4存在:检查装置的气密性,往装置中添加相应的药品,接下来的一步操作为_______________________________ 。
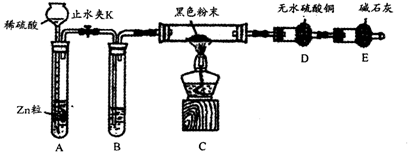
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因。______________________________________ 。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(2)用以下装置可以说明产物有Fe3O4存在:检查装置的气密性,往装置中添加相应的药品,接下来的一步操作为

(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因。
您最近一年使用:0次



