硫酸镁还原热解制备高纯氧化镁是一种新的探索,以解决氧化镁在医药、建筑等行业的应用广泛。现以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
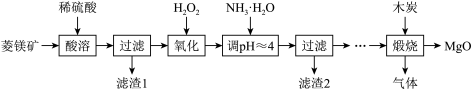
(1)酸溶所涉及反应的离子方程式为_________________________________________ 、_________________________________________________________ 。
(2)加入H2O2氧化的作用是_________________ ,滤渣2的成分是___________ (填化学式)。
(3)煅烧过程存在以下反应:
2MgSO4+C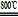 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C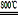 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C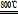 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
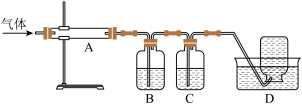
①B中盛放的溶液可以是______ (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c. KMnO4溶液 d. 稀硝酸
②C装置的作用是______________________ ,D中收集的气体可以是 _______ (填化学式)。
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:________________________________________________ 。

(1)酸溶所涉及反应的离子方程式为
(2)加入H2O2氧化的作用是
(3)煅烧过程存在以下反应:
2MgSO4+C
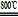 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑MgSO4+C
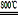 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑MgSO4+3C
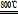 MgO+S↑+3CO↑
MgO+S↑+3CO↑利用下图装置对煅烧产生的气体进行分步吸收或收集。

①B中盛放的溶液可以是
a.NaOH 溶液 b.Na2CO3溶液 c. KMnO4溶液 d. 稀硝酸
②C装置的作用是
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
更新时间:2018-04-20 17:51:49
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,
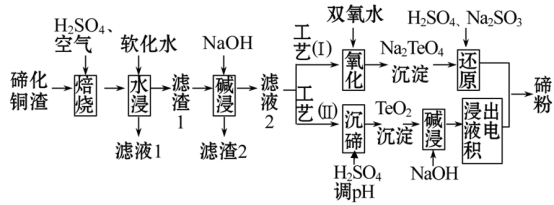
(1)“培烧”后,确主要以TeO2 形式存在,写出相应反应的离子方程式:______ 。
(2)为了选择最佳的培烧工艺进行了温度和硫酸加入量的条件试验,结果如下表所示:
则实验中应选择的条件为___________ ,原因为________________ 。
(3)滤渣1在碱浸时发生的化学方程式为___________ 。
(4)工艺(I)中,“还原”时发生的总的化学方程式为_____ 。
(5)由于工艺(I)中“氧化”对溶液和物料条件要求高。有研究者采用工艺(II)获得磅.则“电积”过程中,阴极的电极反应式为___________ 。
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3 与滤液1合井。进入铜电积系统。该处理措施的优点为______ 。
②滤渣3中若含Au和Ag,可用_____ 将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸

(1)“培烧”后,确主要以TeO2 形式存在,写出相应反应的离子方程式:
(2)为了选择最佳的培烧工艺进行了温度和硫酸加入量的条件试验,结果如下表所示:
温度/℃ | 硫酸加入量(理论量倍数) | 浸出率/% | |
Cu | Te | ||
450 | 1.25 | 77.3 | 2.63 |
460 | 1.00 | 80.29 | 2.81 |
1.25 | 89.86 | 2.87 | |
1.50 | 92.31 | 7.70 | |
500 | 1.25 | 59.83 | 5.48 |
550 | 1.25 | 11.65 | 10.63 |
则实验中应选择的条件为
(3)滤渣1在碱浸时发生的化学方程式为
(4)工艺(I)中,“还原”时发生的总的化学方程式为
(5)由于工艺(I)中“氧化”对溶液和物料条件要求高。有研究者采用工艺(II)获得磅.则“电积”过程中,阴极的电极反应式为
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3 与滤液1合井。进入铜电积系统。该处理措施的优点为
②滤渣3中若含Au和Ag,可用
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是___________________ ,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是___________ 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
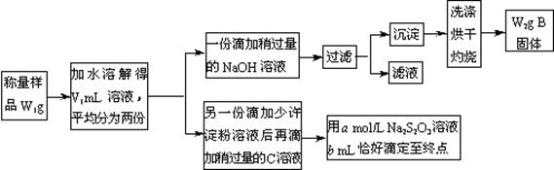
请回答下列问题:
①写出B和C的化学式:B____________ ,C________________ 。
②滴定时,判断滴定达到终点的现象是______________________ 。
③KIO3的质量分数是________________________________ (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)____________
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。

请回答下列问题:
①写出B和C的化学式:B
②滴定时,判断滴定达到终点的现象是
③KIO3的质量分数是
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
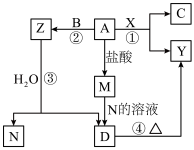
【推荐3】有A、B、C、D、E、F、G7种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素
(1)A的名称是____ ,B位于周期表中第____ 周期____ 族,C的原子结构示意图是________________ 。
(2)E的单质颜色是_______ 。
(3)A元素与D元素形成的化合物的电子式是_________ 。
(4)G的单质与水反应的化学方程式是________ 。
(5)F的元素符号是__________ 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是_____ (填化学式,下同),酸性最强的是_______ ,气态氢化物最稳定的是__________ 。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是_______________ 。
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素
(1)A的名称是
(2)E的单质颜色是
(3)A元素与D元素形成的化合物的电子式是
(4)G的单质与水反应的化学方程式是
(5)F的元素符号是
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】在如图所示的转化关系中,A、B、C为单质,其余方框内的物质均为化合物,B、X、N在常温下均为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中含有同一种元素(框图中某些生成物已经略去)。
已知: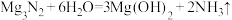 。
。
请填写下列空白。
(1)写出下列有关化学方程式:
①________________________________________________ ;
②________________________________________________ ;
④________________________________________________ 。
(2)试拟定工业上由Y制取单质A的反应原理:______________________________________________ (用化学方程式表示)。
已知:
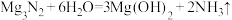 。
。
请填写下列空白。
(1)写出下列有关化学方程式:
①
②
④
(2)试拟定工业上由Y制取单质A的反应原理:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按如图所示流程进行生产,可制得轻质氧化镁。
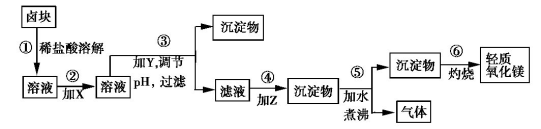
查阅资料得下表相关数据:
已知Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z的最佳选择依次是表2中的_____ (选填试剂编号)。
(2)步骤②发生反应的离子方程式为__________ ;步骤⑤中发生反应的化学方程式为______ 。
(3)为尽量除去杂质,步骤③调节pH为____ 时,停止加入Y。调节为该pH的目的是____ 。
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是____ 。
A.酒精喷灯 B.铁三脚 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)向装有少量Mg(OH)2浊液的试管中加入适量CH3COONH4晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因______ 。

查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 800 |
已知Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z的最佳选择依次是表2中的
(2)步骤②发生反应的离子方程式为
(3)为尽量除去杂质,步骤③调节pH为
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是
A.酒精喷灯 B.铁三脚 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)向装有少量Mg(OH)2浊液的试管中加入适量CH3COONH4晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2。某科学小组通过实验验证反应产物并探究产物的比例关系。资料信息:
2 NO2 +2NaOH=Na NO3+ Na NO2+H2O, Mg3N2+6 H2O=3 Mg(OH)2+2NH3↑
限用如下装置实验(夹持装置省略,部分仪器可重复使用)
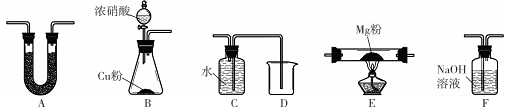
(1)装置连接的顺序为______ (填字母序号);
(2)连接好仪器,装入药品前检验装置气密性的方法是____ ;
(3)装置A中盛装的干燥剂是___ ;装置F的作用_____________ ;
(4)验证产物中存在Mg3 N2的具体实验操作为______________ .确定产物中有N。生成的实验现象为_____________ ;
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:______ 。
2 NO2 +2NaOH=Na NO3+ Na NO2+H2O, Mg3N2+6 H2O=3 Mg(OH)2+2NH3↑
限用如下装置实验(夹持装置省略,部分仪器可重复使用)

(1)装置连接的顺序为
(2)连接好仪器,装入药品前检验装置气密性的方法是
(3)装置A中盛装的干燥剂是
(4)验证产物中存在Mg3 N2的具体实验操作为
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】水合肼(N2H4•H2O)是一种在生产生活中有着广泛用途的精细化工原料,具有强碱性和强还原性。实验室一般采用次氯酸钠(受热易分解)氧化尿素( )制备水合肼,制备过程可分为两个阶段:
)制备水合肼,制备过程可分为两个阶段:
(第一阶段)制备次氯酸钠。
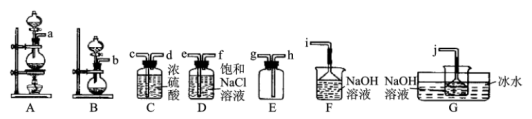
(1)某同学欲从图中选择部分装置,收集一瓶干燥的氯气,其连接次序为:a→__ (按气流方向,用小写字母表示)。
(2)实验中选用G装置作为次氯酸钠的合成装置,并采用冰水浴的原因是__ 。
(第二阶段)制备水合肼。
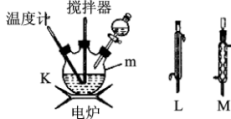
将第一阶段制备的次氯酸钠碱性溶液转移至分液漏斗中,慢慢滴加到盛有尿素的仪器m中,并不断搅拌;然后取下分液漏斗换上X装置,快速升温,在108℃的条件下回流5min;将混合物转移到蒸馏装置中进行蒸馏,收集108~114℃馏分,得水合肼产品。
(3)请写出此阶段制备水合肼的离子反应方程式___ 。
(4)X装置最好选用图中的___ (填“L”或“M”)。
(5)用分液漏斗加入次氯酸钠碱性溶液时,慢慢滴加的目的是__ 。
(6)水合肼还原法制取碘化钠固体,其制备流程如图所示:
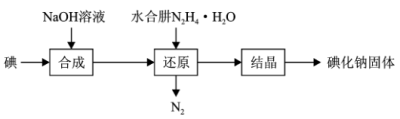
在“还原”过程中,主要消耗“合成”过程中生成的副产物IO ,该过程的化学方程式为
,该过程的化学方程式为__ 。工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是__ 。
 )制备水合肼,制备过程可分为两个阶段:
)制备水合肼,制备过程可分为两个阶段:(第一阶段)制备次氯酸钠。

(1)某同学欲从图中选择部分装置,收集一瓶干燥的氯气,其连接次序为:a→
(2)实验中选用G装置作为次氯酸钠的合成装置,并采用冰水浴的原因是
(第二阶段)制备水合肼。

将第一阶段制备的次氯酸钠碱性溶液转移至分液漏斗中,慢慢滴加到盛有尿素的仪器m中,并不断搅拌;然后取下分液漏斗换上X装置,快速升温,在108℃的条件下回流5min;将混合物转移到蒸馏装置中进行蒸馏,收集108~114℃馏分,得水合肼产品。
(3)请写出此阶段制备水合肼的离子反应方程式
(4)X装置最好选用图中的
(5)用分液漏斗加入次氯酸钠碱性溶液时,慢慢滴加的目的是
(6)水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗“合成”过程中生成的副产物IO
 ,该过程的化学方程式为
,该过程的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】现有含有少NaCl、 、
、 等杂质的
等杂质的 溶液,选择适当的试剂除去杂质,得到纯净的
溶液,选择适当的试剂除去杂质,得到纯净的 固体,实验流程如下图所示。
固体,实验流程如下图所示。

(1)沉淀A的主要成分是___________ (填化学式)。
(2)③加入过量的Y的目的是___________ 。
(3)溶液3中肯定含有的杂质是___________ ,为除去杂质可向溶液3中加入过量的___________ 。
 、
、 等杂质的
等杂质的 溶液,选择适当的试剂除去杂质,得到纯净的
溶液,选择适当的试剂除去杂质,得到纯净的 固体,实验流程如下图所示。
固体,实验流程如下图所示。 
(1)沉淀A的主要成分是
(2)③加入过量的Y的目的是
(3)溶液3中肯定含有的杂质是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
已知:①Cr(OH)3+OH-=CrO2-+2H2O; ②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;M(Cr)=52
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
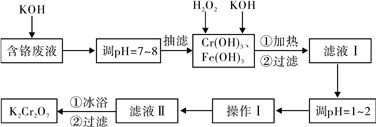
(1)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为_____________________________ 。
(2)滤液Ⅰ酸化前,进行加热的目的是____________________________ ;
冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是________________________ 。
(3)下表是相关物质的溶解度数据:
根据溶解度数据,调节pH选择的试剂是__________________ 。
A.稀盐酸 B.稀硫酸 C.稀硝酸
操作Ⅰ具体操作步骤为①______________________ 、②____________________ 。
(4)称取产品重铬酸钾试样4.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.2400 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
① 若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为__________________________ (列式不计算,设整个过程中其它杂质不参与反应)。
② 若装Na2S2O3标准液的滴定管在滴定前有气泡滴定后没有气泡,测得的重铬酸钾的纯度将:______________________ (填“偏高”、“偏低”、或“不变”)。
已知:①Cr(OH)3+OH-=CrO2-+2H2O; ②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;M(Cr)=52
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。

(1)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为
(2)滤液Ⅰ酸化前,进行加热的目的是
冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是
(3)下表是相关物质的溶解度数据:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,调节pH选择的试剂是
A.稀盐酸 B.稀硫酸 C.稀硝酸
操作Ⅰ具体操作步骤为①
(4)称取产品重铬酸钾试样4.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.2400 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
① 若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为
② 若装Na2S2O3标准液的滴定管在滴定前有气泡滴定后没有气泡,测得的重铬酸钾的纯度将:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】NiCl2是一种重要催化剂。某科研小组以废弃催化剂含Ni2+、Cu2+、Fe3+、Ca2+、Mg2+等)为原料,按下列流程回收NiCl2:6H2O晶体,回答下列问题。

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的主要成分是S和_________ (写化学式),生成S的离子方程式为_____ 。
(2)若用H2O2代替Cl2,试剂Y的使用量会减少,原因是________ 。
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度<10-5mol/L),滤液3中F—的浓度不小___ mol/L。
(4)操作A为______ 、过滤、洗涤、干燥。
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂将所得NiCl2•6H2O与SOCl2混合加热可制备无水NiCl2,反应的化学方程式为____ 。

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的主要成分是S和
(2)若用H2O2代替Cl2,试剂Y的使用量会减少,原因是
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度<10-5mol/L),滤液3中F—的浓度不小
(4)操作A为
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂将所得NiCl2•6H2O与SOCl2混合加热可制备无水NiCl2,反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
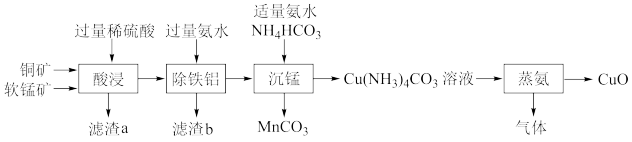
【推荐2】碳酸锰可作为陶瓷、涂料和清漆的原料,氧化铜是玻璃、搪瓷、陶瓷等工业的着色剂。一种利用铜矿(主要成分是CuS,含杂质FeS、 )、软锰矿(主要成分是
)、软锰矿(主要成分是 ,含杂质
,含杂质 、
、 )联合制备
)联合制备 、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
常温下,有关金属离子形成氢氧化物沉淀的pH见下表:
回答下列问题:
(1)“滤渣a”中含硫单质,还含有___________ (填化学式)。
(2)已知 的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:
的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:___________ ,软锰矿稍过量的主要目的是___________ 。
(3)“除铁铝”操作控制溶液的pH最小为___________ 。常温下,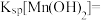
___________ 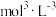 。
。
(4)“沉锰”中涉及的知识有___________ (填标号)。
a.氧化还原反应 b.相互促进水解 c.相互促进电离 d.溶解平衡
(5)“蒸氨”所得气体为混合物,则其成分是___________ (填化学式)。
 )、软锰矿(主要成分是
)、软锰矿(主要成分是 ,含杂质
,含杂质 、
、 )联合制备
)联合制备 、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
常温下,有关金属离子形成氢氧化物沉淀的pH见下表:
| 金属离子 |  |  |  |  |  |
| 开始沉淀时的pH | 7.0 | 2.2 | 3.5 | 5.6 | 8.0 |
沉淀完全时(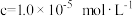 )的pH )的pH | 9.0 | 3.2 | 4.7 | 6.7 | 10.0 |
回答下列问题:
(1)“滤渣a”中含硫单质,还含有
(2)已知
 的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:
的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:(3)“除铁铝”操作控制溶液的pH最小为
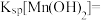
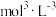 。
。(4)“沉锰”中涉及的知识有
a.氧化还原反应 b.相互促进水解 c.相互促进电离 d.溶解平衡
(5)“蒸氨”所得气体为混合物,则其成分是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】过硫酸铵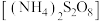 是一种重要的氧化剂、漂白剂。工业上用粗硫酸铵(杂质主要为含铁化合物)生产过硫酸铵的一种工艺流程如图所示。
是一种重要的氧化剂、漂白剂。工业上用粗硫酸铵(杂质主要为含铁化合物)生产过硫酸铵的一种工艺流程如图所示。
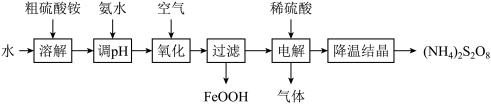
已知: 具有强氧化性和腐蚀性,0℃时在水中的溶解度为58.2g,微溶于乙醇,不溶于丙酮。回答下列问题:
具有强氧化性和腐蚀性,0℃时在水中的溶解度为58.2g,微溶于乙醇,不溶于丙酮。回答下列问题:
(1) 中S元素的化合价为
中S元素的化合价为___________ 该物质中N、O、S元素的第一电离能由大到小的顺序是___________ 。
(2)用离子方程式表示 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
(3)若将等体积、等浓度的氨水和稀硫酸混合后,混合溶液的主要溶质为___________ (填化学式),混合溶液中各离子的浓度由大到小的顺序为___________ 。
(4)FeOOH可用于脱除 ,其产物为FeSSH,常温下,FeSSH经空气氧化可再生出FeOOH,从而循环使用。写出FeOOH再生的化学方程式:
,其产物为FeSSH,常温下,FeSSH经空气氧化可再生出FeOOH,从而循环使用。写出FeOOH再生的化学方程式:___________ 。
(5)降温结晶后所得 晶体经过滤、
晶体经过滤、___________ (填试剂名称)洗涤、干燥可得纯净的 晶体,写出在实验室中洗涤
晶体,写出在实验室中洗涤 晶体的操作:
晶体的操作:___________ 。
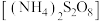 是一种重要的氧化剂、漂白剂。工业上用粗硫酸铵(杂质主要为含铁化合物)生产过硫酸铵的一种工艺流程如图所示。
是一种重要的氧化剂、漂白剂。工业上用粗硫酸铵(杂质主要为含铁化合物)生产过硫酸铵的一种工艺流程如图所示。
已知:
 具有强氧化性和腐蚀性,0℃时在水中的溶解度为58.2g,微溶于乙醇,不溶于丙酮。回答下列问题:
具有强氧化性和腐蚀性,0℃时在水中的溶解度为58.2g,微溶于乙醇,不溶于丙酮。回答下列问题:(1)
 中S元素的化合价为
中S元素的化合价为(2)用离子方程式表示
 溶液呈酸性的原因:
溶液呈酸性的原因:(3)若将等体积、等浓度的氨水和稀硫酸混合后,混合溶液的主要溶质为
(4)FeOOH可用于脱除
 ,其产物为FeSSH,常温下,FeSSH经空气氧化可再生出FeOOH,从而循环使用。写出FeOOH再生的化学方程式:
,其产物为FeSSH,常温下,FeSSH经空气氧化可再生出FeOOH,从而循环使用。写出FeOOH再生的化学方程式:(5)降温结晶后所得
 晶体经过滤、
晶体经过滤、 晶体,写出在实验室中洗涤
晶体,写出在实验室中洗涤 晶体的操作:
晶体的操作:
您最近一年使用:0次



