物质的量是沟通宏观与微观的桥梁,物质的量的计算在生产、生活、科技等方面具有广泛的应用。请回答下列问题:
(1)一定量的液态化合物XY2,在足量的O2中完全燃烧,反应的方程式为:XY2 (液)+3O2 (气)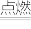 XO2(气) +2YO2(气)。
XO2(气) +2YO2(气)。
①若参加反应的XY2的物质的量为0.01 mol,则生成的气体XO2和YO2的体积比为____ ;
②若测得反应后混合气体的总体积为896 mL(标况下),则反应前O2的物质的量为_____ 。
(2)病人输液用的葡萄糖(化学式为C6H12O6)注射液,其标签上的部分内容如图所示。
①该注射液的密度为_____ g/cm3;
②该注射液中葡萄糖的物质的量浓度为________ 。
(3)实验室为完成某实验,需要0.1 mol/L的Na2CO3溶液490 mL。
①配制所需Na2CO3溶液用到的玻璃仪器为_______________ ;
②下列实验操作造成所配溶液的浓度偏低的是______ (填标号)。
A.忘记将洗涤液转移至容量瓶中 B.托盘天平的砝码生锈
C.容量瓶的内壁附有水珠而未进行干燥处理 D.定容时,俯视容量瓶的刻度线
(1)一定量的液态化合物XY2,在足量的O2中完全燃烧,反应的方程式为:XY2 (液)+3O2 (气)
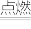 XO2(气) +2YO2(气)。
XO2(气) +2YO2(气)。①若参加反应的XY2的物质的量为0.01 mol,则生成的气体XO2和YO2的体积比为
②若测得反应后混合气体的总体积为896 mL(标况下),则反应前O2的物质的量为
(2)病人输液用的葡萄糖(化学式为C6H12O6)注射液,其标签上的部分内容如图所示。
5%葡萄糖注射液 500mL 【性状】本品为无色或几乎无色的透明液体, 味甜。 【规格】500mL, 25g 【贮藏】密封保存 |
②该注射液中葡萄糖的物质的量浓度为
(3)实验室为完成某实验,需要0.1 mol/L的Na2CO3溶液490 mL。
①配制所需Na2CO3溶液用到的玻璃仪器为
②下列实验操作造成所配溶液的浓度偏低的是
A.忘记将洗涤液转移至容量瓶中 B.托盘天平的砝码生锈
C.容量瓶的内壁附有水珠而未进行干燥处理 D.定容时,俯视容量瓶的刻度线
更新时间:2017/12/27 14:21:08
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】透明氧化铁黄具有优良着色性能和保色性且使用安全,受到广泛重视,某研究性学习小组拟用硫酸亚铁做原料进行制备,实验流程如图所示:
(1)步骤④用到的仪器除铁架台(带铁圈)、烧杯、玻璃棒之外还需要_______ ;步骤⑨用到的仪器是_______ 。
(2)步骤②发生反应的离子方程式为_______ 。
(3)步骤④所得滤渣的主要成分是_______ (写化学式)。
(4)证明步骤⑤已洗涤干净的方法是_______ 。
(5)步骤②中除用 氧化之外,还可以用
氧化之外,还可以用 氧化,若有2.78g
氧化,若有2.78g 溶解后通氧气,至少需通入标准状况下
溶解后通氧气,至少需通入标准状况下
_______ mL。
(6)将透明氧化铁黄溶于水制得的胶体不具有的性质或用途是_______(填字母)。
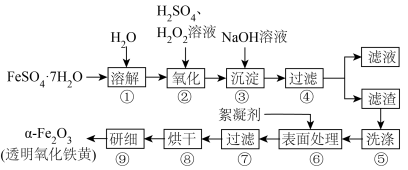
(1)步骤④用到的仪器除铁架台(带铁圈)、烧杯、玻璃棒之外还需要
(2)步骤②发生反应的离子方程式为
(3)步骤④所得滤渣的主要成分是
(4)证明步骤⑤已洗涤干净的方法是
(5)步骤②中除用
 氧化之外,还可以用
氧化之外,还可以用 氧化,若有2.78g
氧化,若有2.78g 溶解后通氧气,至少需通入标准状况下
溶解后通氧气,至少需通入标准状况下
(6)将透明氧化铁黄溶于水制得的胶体不具有的性质或用途是_______(填字母)。
| A.分散质的直径为1nm~100nm | B.用激光笔照射时,有一条光亮的通路 |
| C.可用作除氧剂 | D.肉眼很难区分该胶体和溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】为了将可称量的物质与难以称量的微观粒子之间联系起来,国际上采用了“物质的量”这一物理量,据此完成下列试题:
(1)等质量的O2和O3所含分子的物质的量之比为___ 。
(2)等温等压下,等体积的O2和O3所含分子个数比为___ ,质量比为___ 。
(3)设NA为阿伏加 德罗常数的值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___ (用含a、b、c、NA的式子表示)。
(4)实验室需要配制100mL1mol/L的NaOH溶液,进行如下操作:
①配制该溶液所需主要仪器除了托盘天平、玻璃棒、烧杯、胶头滴管,还需要的玻璃仪器___ 。
②计算需要NaOH固体的质量:___ g。
③取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为___ 。
④若出现如下情况,导致所配溶液浓度偏高的是___ 。
A.称量时砝码已经生锈
B.定容时仰视
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作
D.定容摇匀后,液面低于容量瓶颈上的刻度线
(1)等质量的O2和O3所含分子的物质的量之比为
(2)等温等压下,等体积的O2和O3所含分子个数比为
(3)设NA为阿伏加 德罗常数的值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是
(4)实验室需要配制100mL1mol/L的NaOH溶液,进行如下操作:
①配制该溶液所需主要仪器除了托盘天平、玻璃棒、烧杯、胶头滴管,还需要的玻璃仪器
②计算需要NaOH固体的质量:
③取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为
④若出现如下情况,导致所配溶液浓度偏高的是
A.称量时砝码已经生锈
B.定容时仰视
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作
D.定容摇匀后,液面低于容量瓶颈上的刻度线
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
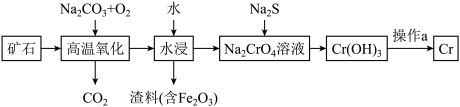
已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为______ 价。
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为_____________________ 。
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:_________________________ 。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:______________ 、____________ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:________________ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为___________ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室配制100mL1.00mol/LNaOH溶液,步骤如下:
①计算配制100mL1.00mol/LNaOH所需NaOH固体的质量并称量。
②将配置好的溶液倒入试剂瓶中,贴好标签。
③继续向容量瓶中加蒸馏水,直到液面距刻度以下1~2cm时,改用胶头滴管滴加蒸馏水,至液面与刻度线相切。盖好容量瓶瓶塞,反复上下颠倒,摇匀。
④将烧杯中的溶液沿玻璃棒注入容量瓶,用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
⑤把称量的NaOH固体放入烧杯中,再向烧杯中加入40ml蒸馏水并用玻璃棒搅拌,使NaOH固体完全溶解。
请回答下列问题:
(1)步骤①称量的NaOH固体质量为___________ g,本实验用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和___________ ,上述操作步骤的正确顺序为___________ (填序号)。
(2)下列操作对配置NaOH溶液浓度的影响(填“偏高”、“偏低”或“无影响”)。
(3)取1.00mol/LNaOH测定20.00mL未知浓度盐酸的浓度,四次测定所消耗NaOH溶液的体积(下表),计算出盐酸的浓度为___________ mol/L。
①计算配制100mL1.00mol/LNaOH所需NaOH固体的质量并称量。
②将配置好的溶液倒入试剂瓶中,贴好标签。
③继续向容量瓶中加蒸馏水,直到液面距刻度以下1~2cm时,改用胶头滴管滴加蒸馏水,至液面与刻度线相切。盖好容量瓶瓶塞,反复上下颠倒,摇匀。
④将烧杯中的溶液沿玻璃棒注入容量瓶,用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
⑤把称量的NaOH固体放入烧杯中,再向烧杯中加入40ml蒸馏水并用玻璃棒搅拌,使NaOH固体完全溶解。
请回答下列问题:
(1)步骤①称量的NaOH固体质量为
(2)下列操作对配置NaOH溶液浓度的影响(填“偏高”、“偏低”或“无影响”)。
| ①定容时俯视刻度线 | |
| ②向容量瓶中转移溶液时有溶液流到容量瓶外面 | |
| ③未用蒸馏水洗涤烧杯和玻璃棒 |
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
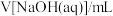 | 25.10 | 25.00 | 24.90 | 26.00 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】用36.5%、密度为1.19g/cm3的浓盐酸配制0.1mol/L的稀盐酸500mL,请回答:
(1)用量筒量取所需浓盐酸的体积为___ mL。
(2)实验配制稀盐酸,所用到的玻璃仪器:___ 、___ 、___ 、___ 、量筒。
(3)如果在配制过程中,第一次加水量太少,搅拌时间较长,导致配制溶液的浓度___ (偏大,偏小或不影响)
(1)用量筒量取所需浓盐酸的体积为
(2)实验配制稀盐酸,所用到的玻璃仪器:
(3)如果在配制过程中,第一次加水量太少,搅拌时间较长,导致配制溶液的浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室欲配制100 mL 1.0 mol·L-1的Na2CO3溶液。
(1)配制上述溶液,下列没有用到的仪器是_______(填字母)。
(2)除上述仪器外,还一定用到的玻璃仪器是_______ 。
(3)用托盘天平称取Na2CO3·10H2O固体的质量为_______ g,从下表中选择称量Na2CO3·10H2O固体所需要的仪器_______ (填字母)。
(4)下列情况使所配溶液的浓度如何变化?
①未洗涤溶解Na2CO3·10H2O的烧杯_______ (填“偏大”“偏小”或“不变”,下同)。
②容量瓶使用前用蒸馏水洗过,内壁附有水珠_______ 。
③定容时加蒸馏水超过了刻度线,将多出的液体吸出_______ 。
④定容时俯视容量瓶刻度线_______ 。
(1)配制上述溶液,下列没有用到的仪器是_______(填字母)。
| A.烧杯 | B.大试管 | C.胶头滴管 | D.100 mL容量瓶 |
(3)用托盘天平称取Na2CO3·10H2O固体的质量为
| 名称 | 托盘天平(带砝码) | 烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |
|
|
|
|
|
|
| 标号 | a | b | c | d | e | f |
①未洗涤溶解Na2CO3·10H2O的烧杯
②容量瓶使用前用蒸馏水洗过,内壁附有水珠
③定容时加蒸馏水超过了刻度线,将多出的液体吸出
④定容时俯视容量瓶刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】用98%的浓硫酸(其密度为1.84g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,
(1)经计算,应用 (填仪器名称及规格,下同)取浓硫酸 。
(2)配制操作可分解成如下几步,以下正确的操作顺序是_____________________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需 __________、 __________。
(4)玻璃棒在整个实验中的作用是 、 。
(5)由于错误操作, 使得到的浓度数据比正确的偏大的是___________________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
(1)经计算,应用 (填仪器名称及规格,下同)取浓硫酸 。
(2)配制操作可分解成如下几步,以下正确的操作顺序是_____________________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需 __________、 __________。
(4)玻璃棒在整个实验中的作用是 、 。
(5)由于错误操作, 使得到的浓度数据比正确的偏大的是___________________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1。由图中可以看出,该同学在操作时的一个错误是___ ,烧杯的实际质量为____ g。
(2)需配制250mL0.2mol•L-1氯化钠溶液,图2是该同学转移溶液的示意图。指出上面图2中存在的两个错误:①____ ②____ 。
(3)用质量分数为98%密度为1.84g•cm-3的浓硫酸配制1000mL0.1mol·L-1稀硫酸。
①应用量筒量取浓硫酸____ mL。
②配制硫酸溶液时需要用到的仪器有___ 、____ 、___ 、___ (除量筒外,写出其余四种)。
③下列操作结果,使所配制溶液物质的量浓度偏高的是____ 。
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.定容时俯视刻度线
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线

(2)需配制250mL0.2mol•L-1氯化钠溶液,图2是该同学转移溶液的示意图。指出上面图2中存在的两个错误:①
(3)用质量分数为98%密度为1.84g•cm-3的浓硫酸配制1000mL0.1mol·L-1稀硫酸。
①应用量筒量取浓硫酸
②配制硫酸溶液时需要用到的仪器有
③下列操作结果,使所配制溶液物质的量浓度偏高的是
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.定容时俯视刻度线
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】已知某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。回答下列问题:

(1)该“84消毒液”的物质的量浓度约为____ (结果精确到0.1)mol•L-1。
(2)某同学取100mL该“84消毒液”,稀释100倍后用于消毒,稀释后的溶液中c(Na+)=____ mol•L-1。
(3)该同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是____ (填字母)。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)
①定容时仰视容量瓶刻度线____ 。
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面____ 。
③容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净____ 。
④定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线____ 。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组用98%(ρ=1.84g•cm-3)的浓硫酸配制2L2.3mol•L-1的稀硫酸用于增强“84消毒液”的消毒能力,需用浓硫酸的体积为____ mL。

(1)该“84消毒液”的物质的量浓度约为
(2)某同学取100mL该“84消毒液”,稀释100倍后用于消毒,稀释后的溶液中c(Na+)=
(3)该同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是

| A.如图2所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.需要称量NaClO固体的质量为123.0g |
| D.配制该溶液的操作顺序:计算→称量→溶解→移液→洗涤→定容→摇匀 |
①定容时仰视容量瓶刻度线
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面
③容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
④定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组用98%(ρ=1.84g•cm-3)的浓硫酸配制2L2.3mol•L-1的稀硫酸用于增强“84消毒液”的消毒能力,需用浓硫酸的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室需要用烧碱固体配制0.5mol·L-1的NaOH溶液500mL。根据配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_______ (填序号)。
(2)计算结果:需要称取NaOH固体_______ g;
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)_______ ;
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)实验操作过程中(4)的B、C步骤均用到玻璃棒,其作用分别是:_______ 、_______ ;
(5)若出现如下情况,其中将引起所配溶液浓度偏低的是_______ ;(填下列编号)
①容量瓶实验前用水洗干净,但未烘干;
②定容观察液面时俯视;
③配制过程中遗漏了(3)中步骤A;
④加蒸馏水时不慎超过刻度线。
(1)如图所示的仪器中配制溶液肯定不需要的是

(2)计算结果:需要称取NaOH固体
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)实验操作过程中(4)的B、C步骤均用到玻璃棒,其作用分别是:
(5)若出现如下情况,其中将引起所配溶液浓度偏低的是
①容量瓶实验前用水洗干净,但未烘干;
②定容观察液面时俯视;
③配制过程中遗漏了(3)中步骤A;
④加蒸馏水时不慎超过刻度线。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】硫酸亚铁铵[ ]、绿矾(
]、绿矾( )均是用途广泛的亚铁盐,但在空气中前者比后者较难被氧化。
)均是用途广泛的亚铁盐,但在空气中前者比后者较难被氧化。
(1)证明“前者比后者较难被氧化”的实验操作是:将一定量的放置一段时间的两种盐配成等物质的量浓度的两种溶液,向其中分别滴加几滴_________ 溶液(填化学式),可能观察到的现象是__________ 。
(2)欲利用硫酸亚铁铵晶体配制500mL0.2 的溶液。下列仪器中有部分可用于该溶液的配制,但还缺少的玻璃仪器的名称是
的溶液。下列仪器中有部分可用于该溶液的配制,但还缺少的玻璃仪器的名称是___________ 。
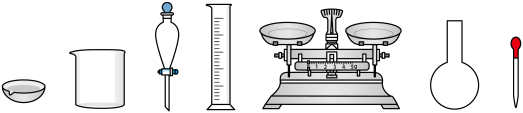
(3)用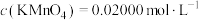 的酸性标准溶液滴定绿矾溶液可测出绿矾溶液中
的酸性标准溶液滴定绿矾溶液可测出绿矾溶液中 的浓度。
的浓度。
①若滴定终点时不小心导致标准溶液滴入过量了,简便的补救方案是___________ 。
②三次平行滴定实验中消耗酸性 溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示:
溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示:
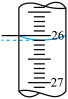
则表中
___________ mL,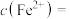
___________  (列出计算式即可)。
(列出计算式即可)。
 ]、绿矾(
]、绿矾( )均是用途广泛的亚铁盐,但在空气中前者比后者较难被氧化。
)均是用途广泛的亚铁盐,但在空气中前者比后者较难被氧化。(1)证明“前者比后者较难被氧化”的实验操作是:将一定量的放置一段时间的两种盐配成等物质的量浓度的两种溶液,向其中分别滴加几滴
(2)欲利用硫酸亚铁铵晶体配制500mL0.2
 的溶液。下列仪器中有部分可用于该溶液的配制,但还缺少的玻璃仪器的名称是
的溶液。下列仪器中有部分可用于该溶液的配制,但还缺少的玻璃仪器的名称是
(3)用
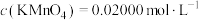 的酸性标准溶液滴定绿矾溶液可测出绿矾溶液中
的酸性标准溶液滴定绿矾溶液可测出绿矾溶液中 的浓度。
的浓度。①若滴定终点时不小心导致标准溶液滴入过量了,简便的补救方案是
②三次平行滴定实验中消耗酸性
 溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示:
溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示:
| 滴定次数 | 待测溶液体积/mL | 标准溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.01 |  |
| 第二次 | 25.00 | 1.56 | 29.30 |
| 第三次 | 25.00 | 0.22 | 26.33 |

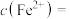
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】为了测定某未知NaOH溶液的浓度,需要0.200mol·L-1的盐酸溶液500mL。某学生用实验室中常用的36.5%(密度为1.20g·cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用_____ (从以下备选仪器中选取适当仪器,将其序号填入空格中)量取36.5%(密度为1.20g·cm-3)的浓盐酸________ mL。a.50mL量筒; b.10mL量筒; c.托盘天平。
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入______________________ (填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中。
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是___________________________________ 。
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为____ mol·L-1(精确到0.01)。
⑶下列操作或叙述正确的是_____ (填写序号)。
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是_____________________ (填写序号)。
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
您最近一年使用:0次









