据题目提供的溶度积数据进行计算并回答下列问题:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO32-)=10-3mol·L-1,则Ca2+是否沉淀完全?________ (填“是”或“否”)。[已知c(Ca2+)≤10-5mol·L-1时可视为沉淀完全,Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=4.0×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
25 ℃ 时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________ 。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________ mol·L-1 。
②完全沉淀后,溶液的pH=__________ 。
(4) 已知常温下Ksp[Fe(OH)3]=1×10-39,某CuSO4溶液中含有Fe3+,可以加入_________ 调节溶液的pH=___________ 使溶液中的c(Fe3+)=10-5 mol/L除去
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO32-)=10-3mol·L-1,则Ca2+是否沉淀完全?
(2)已知25℃时,Ksp[Mg(OH)2]=4.0×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃ 时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
(4) 已知常温下Ksp[Fe(OH)3]=1×10-39,某CuSO4溶液中含有Fe3+,可以加入
18-19高二上·吉林白城·阶段练习 查看更多[2]
更新时间:2018/10/22 12:58:31
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
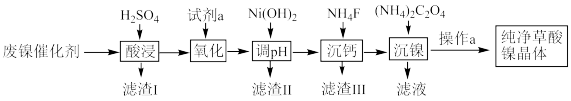
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:________________________________ ,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________ ,当Ca2+沉淀完全时,溶液中c(F-)>____________ mol·L-1(写出计算式即可)。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
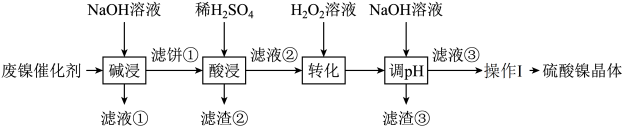
【推荐2】某油脂厂废弃的油脂加氢镍催化剂主要含金属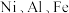 及其氧化物,还有少量其它不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其它不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)元素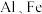 在元素周期表中分别位于
在元素周期表中分别位于__________ 区、__________ 区。
(2)“碱浸中 溶液的两个作用分别是
溶液的两个作用分别是____________________ 、____________________ 。
(3)“滤液②”中含有的金属离子有______________________________ 。
(4)“转化”中发生的离子方程式为______________________________ 。
若工艺流程改为先“调 ”后“转化”,即:如下操作:
”后“转化”,即:如下操作:
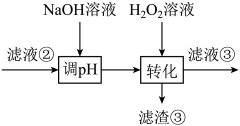
则“滤液③”中可能含有的杂质离子为____________________ 。
(5)“转化”后加 溶液“调
溶液“调 应控制的
应控制的 范围是
范围是______________________________ ;操作I的具体操作是__________ ,过滤,洗涤,干燥。
(6)硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式______________________________ 。
 及其氧化物,还有少量其它不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其它不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
开始沉淀时的 | 6.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)元素
 在元素周期表中分别位于
在元素周期表中分别位于(2)“碱浸中
 溶液的两个作用分别是
溶液的两个作用分别是(3)“滤液②”中含有的金属离子有
(4)“转化”中发生的离子方程式为
若工艺流程改为先“调
 ”后“转化”,即:如下操作:
”后“转化”,即:如下操作:
则“滤液③”中可能含有的杂质离子为
(5)“转化”后加
 溶液“调
溶液“调 应控制的
应控制的 范围是
范围是(6)硫酸镍在强碱溶液中用
 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:

已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________ 。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________ 。
(3) “除铁”时需控制溶液的pH范围为________ 。
(4) “滤渣”的主要成分为___________ (填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________ 。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________ 。

已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
| 开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
| 沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是
(2) “氧化”时,Fe2+参加反应的离子方程式为
(3) “除铁”时需控制溶液的pH范围为
(4) “滤渣”的主要成分为
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】钼酸钠晶体( )用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为
)用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为 ,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。
,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。

(1) 中Mo的化合价为
中Mo的化合价为___________
(2)“焙烧”时,有 生成,反应的化学方程式为
生成,反应的化学方程式为___________ ,氧化产物是___________
(3)“碱浸”生成 和另外一种物质,
和另外一种物质, 的电子式为
的电子式为___________ ,另外一种生成物的化学式为___________
(4)若“除重金属离子”时加入的沉淀剂为 ,则废渣的成分为
,则废渣的成分为___________ (填化学式)
(5)测得“除重金属离子”中部分离子的浓度: “结晶”前应先除去
“结晶”前应先除去 ,方法是加入
,方法是加入 固体。假设加入
固体。假设加入 固体后溶液体积不变,当
固体后溶液体积不变,当 开始沉淀时,去除的
开始沉淀时,去除的 的质量分数为
的质量分数为___________ %。(保留小数点后一位数字)[已知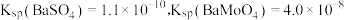 ]
]
(6)在碱性条件下,将钼精矿加入NaClO溶液中,也可以制备钼酸钠。该反应的离子方程式为___________ 。
 )用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为
)用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为 ,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。
,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。
(1)
 中Mo的化合价为
中Mo的化合价为(2)“焙烧”时,有
 生成,反应的化学方程式为
生成,反应的化学方程式为(3)“碱浸”生成
 和另外一种物质,
和另外一种物质, 的电子式为
的电子式为(4)若“除重金属离子”时加入的沉淀剂为
 ,则废渣的成分为
,则废渣的成分为(5)测得“除重金属离子”中部分离子的浓度:
 “结晶”前应先除去
“结晶”前应先除去 ,方法是加入
,方法是加入 固体。假设加入
固体。假设加入 固体后溶液体积不变,当
固体后溶液体积不变,当 开始沉淀时,去除的
开始沉淀时,去除的 的质量分数为
的质量分数为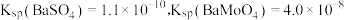 ]
](6)在碱性条件下,将钼精矿加入NaClO溶液中,也可以制备钼酸钠。该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】软锰矿是一种常见的锰矿物,主要成分是MnO2,常含有铁、铝元素形成的杂质。工业上,用软锰矿制取高锰酸钾的流程如下(部分条件和产物省略):
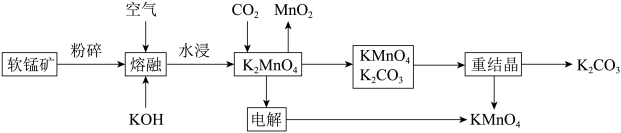
请回答下列问题:
(1)Mn的价层电子排布式为_______ ;杂质中的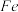 元素在元素周期表中的位置为
元素在元素周期表中的位置为_______ 。
(2)CO2与K2MnO4反应的离子方程式为_______ 。
(3)KMnO4与K2CO3能用重结晶(冷却结晶)的方法分离的原理是_______ 。
(4)“电解”过程中使用的是惰性电极,则:
①阴极附近溶液的pH将_______ (填“增大”“减小”或“不变”)。
②工业上可用石墨为电极电解硫酸锰和硫酸的混合溶液制备MnO2,其阳极的电极反应式为_______ 。
(5)可用过氧化氢溶液滴定的方法测定高锰酸钾样品纯度。当达到滴定终点时,溶液中产生的现象为_______ 。
(6)常温下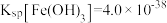 ,
, 。常温下,若某溶液中,
。常温下,若某溶液中, ,
, ,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=_______ mol/L。

请回答下列问题:
(1)Mn的价层电子排布式为
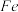 元素在元素周期表中的位置为
元素在元素周期表中的位置为(2)CO2与K2MnO4反应的离子方程式为
(3)KMnO4与K2CO3能用重结晶(冷却结晶)的方法分离的原理是
(4)“电解”过程中使用的是惰性电极,则:
①阴极附近溶液的pH将
②工业上可用石墨为电极电解硫酸锰和硫酸的混合溶液制备MnO2,其阳极的电极反应式为
(5)可用过氧化氢溶液滴定的方法测定高锰酸钾样品纯度。当达到滴定终点时,溶液中产生的现象为
(6)常温下
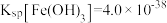 ,
, 。常温下,若某溶液中,
。常温下,若某溶液中, ,
, ,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】锰的氧化物被广泛应用于电子行业、化学工业及环境保护等领域。一种以低品位菱锰矿(含MnCO3、FeCO3、Fe2O3、CaCO3、MgCO3、Al2O3、SiO2等)制备四氧化三锰(Mn3O4)和二氧化锰(MnO2)的过程如下:
(1)酸浸:向粉碎后的菱锰矿中加入足量20%的硫酸,充分浸出后,过滤。所得滤液中Mn2+的电子排布式为___________ 。
(2)除铁、铝:向(1)所得滤液中加入合适的氧化剂将Fe2+完全氧化为Fe3+后,滴加NaOH溶液调节溶液pH在5~6之间,过滤。溶液的pH不能超过6的原因是___________ 。
(3)除镁、钙:向(2)所得滤液中加入一定量NaF溶液,充分反应后过滤。
①已知常温下:Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.4×10−9.则反应CaF2(s)+Mg2+(aq) MgF2(s)+Ca2+(aq)的平衡常数为K=
MgF2(s)+Ca2+(aq)的平衡常数为K=___________ 。
②除镁、钙时,溶液的pH过低会导致Ca2+、Mg2+沉淀不完全,原因是___________ 。
(4)制Mn3O4:向(3)所得滤液加入氨水并鼓入空气充分搅拌,有棕褐色沉淀Mn3O4生成。该反应的离子方程式为___________ 。
(5)制MnO2:另取等体积(3)所得滤液(pH在5~6之间)两份,向其中一份中加入双氧水,无明显现象;另一份先加入NaOH溶液至溶液呈碱性,再加入等量的双氧水,有黑色MnO2固体生成。产生上述不同现象的原因是___________ (已知:H2O2的氧化性随pH的增大而减弱)。
(1)酸浸:向粉碎后的菱锰矿中加入足量20%的硫酸,充分浸出后,过滤。所得滤液中Mn2+的电子排布式为
(2)除铁、铝:向(1)所得滤液中加入合适的氧化剂将Fe2+完全氧化为Fe3+后,滴加NaOH溶液调节溶液pH在5~6之间,过滤。溶液的pH不能超过6的原因是
(3)除镁、钙:向(2)所得滤液中加入一定量NaF溶液,充分反应后过滤。
①已知常温下:Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.4×10−9.则反应CaF2(s)+Mg2+(aq)
 MgF2(s)+Ca2+(aq)的平衡常数为K=
MgF2(s)+Ca2+(aq)的平衡常数为K=②除镁、钙时,溶液的pH过低会导致Ca2+、Mg2+沉淀不完全,原因是
(4)制Mn3O4:向(3)所得滤液加入氨水并鼓入空气充分搅拌,有棕褐色沉淀Mn3O4生成。该反应的离子方程式为
(5)制MnO2:另取等体积(3)所得滤液(pH在5~6之间)两份,向其中一份中加入双氧水,无明显现象;另一份先加入NaOH溶液至溶液呈碱性,再加入等量的双氧水,有黑色MnO2固体生成。产生上述不同现象的原因是
您最近一年使用:0次



