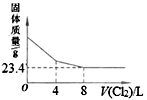
二氧化氯是一种黄绿色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒。
(1)在进行饮用水消毒时,ClO2可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,据此说明ClO2具有________ 性。
(2)液氯也常用作自来水消毒。已知ClO2、Cl2的还原产物均为Cl-,则相同物质的量的ClO2的消毒效率是Cl2的_____ 倍。(消毒效率指单位物质的量的物质的得电子数)
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,使碘游离出来。已知:8HCl + 2ClO2 + 10KI === 5I2 + 10KCl + 4H2O。
操作Ⅱ: 加入一定量的Na2S2O3溶液。(已知:2Na2S2O3+I2===Na2S4O6+2NaI)
请回答:
①操作Ⅰ中反应的离子方程式是___________________________________________ 。
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是_______ mg·L-1。
(1)在进行饮用水消毒时,ClO2可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,据此说明ClO2具有
(2)液氯也常用作自来水消毒。已知ClO2、Cl2的还原产物均为Cl-,则相同物质的量的ClO2的消毒效率是Cl2的
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,使碘游离出来。已知:8HCl + 2ClO2 + 10KI === 5I2 + 10KCl + 4H2O。
操作Ⅱ: 加入一定量的Na2S2O3溶液。(已知:2Na2S2O3+I2===Na2S4O6+2NaI)
请回答:
①操作Ⅰ中反应的离子方程式是
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是
更新时间:2018-11-13 14:49:53
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下:Na2SO4+4C →Na2S+ 4CO,Na2SO4+4CO→Na2S+4CO2
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S_____ g,最多生成标况下的CO_____ L。
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是____ mol≤n≤___ mol,若生成等物质的量CO和CO2,则消耗的碳的物质的量为____ mol。
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。_____
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________ 。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式__________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________ 和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】下表是某食用碘盐包装袋上的部分说明:
请回答下列问题:
(1)下列说法正确的是___________ 。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为___________________ 。
w.该反应的还原剂为_____ ;1mol KIO3完全反应转移的电子总数为______ 。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)_________ mg/kg。
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为
w.该反应的还原剂为
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】某混合碱的组成可表示为xNa2CO3•yNaHCO3•zH2O,用滴定法分析其组成。实验如下,称取4.54 0g固体,溶解后定容至100mL。取10.00mL溶液,加入2-3滴酚酞,用0.100mol/L盐酸滴定至第一次终点,再加入2-3滴甲基橙,继续用0.100 0mol/L盐酸滴定至第二次终点。重复实验,具体数据如下:
已知:NaHCO3溶液pH=8.3,饱和H2CO3pH=3.9
该混合碱的化学式为___________ ;写出简要计算过程:___________
序号 | 滴定前读数/mL | 第一次终点读数/mL | 第二次终点读数/mL |
1 | 0.00 | 9.98 | 39.96 |
2 | 1.26 | 12.40 | 42.40 |
3 | 0.00 | 10.02 | 41.12 |
4 | 1.54 | 11.56 | 41.58 |
已知:NaHCO3溶液pH=8.3,饱和H2CO3pH=3.9
该混合碱的化学式为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】混合碱(Na2CO3与NaHCO3,或Na2CO3与NaOH的混合物)的成分及含量可用双指示剂法测定。步骤如下:取混合碱溶液25.00 mL,滴加2滴酚酞为指示剂,用0.2000 mol·L−1的盐酸滴定液滴定至溶液呈微红色,记下消耗盐酸体积为22.50 mL;再滴加2滴甲基橙,继续滴定至溶液由黄色变为橙色,记下第二次滴定消耗盐酸的体积12.50 mL。(已知:H2CO3的Ka1 = 4.3 × 10-7;Ka2 = 5.6 × 10-11)
请计算:
(1)混合碱成分及物质的量之比为___________ 。
(2)混合碱溶液中Na2CO3的浓度为___________ mol·L−1.(写出计算过程)
请计算:
(1)混合碱成分及物质的量之比为
(2)混合碱溶液中Na2CO3的浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】有下列化合物:①NaCl②NaOH③HCl④FeCl3⑤CH3COONa⑥CH3COOH⑦NH3•H2O⑧H2O
请回答下列问题:
(1)FeCl3溶液显__________ 性,用离子方程式表示______________________ ;
CH3COOH溶液显________ 性,用离子方程式表示__________________________ ;
(2)常温下,pH=10的CH3COONa溶液中,水电离出来的c(OH-)=_________________ ;
在pH=3HCl的溶液中,水电离出来的c(H+)=___________________ ;
(3)已知水存在如下平衡:H2O+H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是____________ 。
A.向水中加入NaHSO4固体
B.向水中加入(NH4)2SO4固体
C.加热至100℃[其中c(H+)=1×10-6mol•L-1]
D、向水中加Na2CO3固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则m___________ n(填“<”、“>”或“=”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va_____ Vb(填“>”、“<”、“=”、“无法确定”)
(6)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:______________________________________________ (填序号)。
(7)常温下pH=13的NaOH溶液与pH=2的盐酸溶液混合,所得混合液的pH=11,则NaOH与盐酸的体积比为________
请回答下列问题:
(1)FeCl3溶液显
CH3COOH溶液显
(2)常温下,pH=10的CH3COONa溶液中,水电离出来的c(OH-)=
在pH=3HCl的溶液中,水电离出来的c(H+)=
(3)已知水存在如下平衡:H2O+H2O
 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是A.向水中加入NaHSO4固体
B.向水中加入(NH4)2SO4固体
C.加热至100℃[其中c(H+)=1×10-6mol•L-1]
D、向水中加Na2CO3固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则m
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va
(6)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:
(7)常温下pH=13的NaOH溶液与pH=2的盐酸溶液混合,所得混合液的pH=11,则NaOH与盐酸的体积比为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】有Fe和Fe2O3的混合物溶于500ml的稀硝酸中,放出NO22.4L(标况下)并余5.44g Fe,向反应后的溶液中通入20.16LCl2(标况),恰好能使溶液中的Fe2+全部氧化。
求:(1)稀硝酸的物质的量浓度____
(2)混合物中Fe的质量分数____
求:(1)稀硝酸的物质的量浓度
(2)混合物中Fe的质量分数
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】取一定量的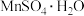 样品在空气中加热,其固体残留率随温度的变化如图。已知:样品的固体残留率=固体样品的剩余质量/固体样品的起始质量×100;样品在300℃时已完全失去结晶水,900℃以上残余固体为金属氧化物。
样品在空气中加热,其固体残留率随温度的变化如图。已知:样品的固体残留率=固体样品的剩余质量/固体样品的起始质量×100;样品在300℃时已完全失去结晶水,900℃以上残余固体为金属氧化物。
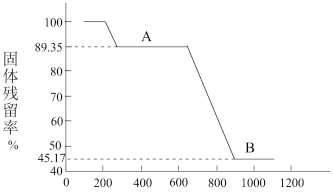
请回答:
(1)加热至500℃时的过程中,样品固体发生分解的化学方程式是_______ 。
(2)曲线B段所表示物质的化学式是_______ (写出计算过程)。
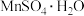 样品在空气中加热,其固体残留率随温度的变化如图。已知:样品的固体残留率=固体样品的剩余质量/固体样品的起始质量×100;样品在300℃时已完全失去结晶水,900℃以上残余固体为金属氧化物。
样品在空气中加热,其固体残留率随温度的变化如图。已知:样品的固体残留率=固体样品的剩余质量/固体样品的起始质量×100;样品在300℃时已完全失去结晶水,900℃以上残余固体为金属氧化物。
请回答:
(1)加热至500℃时的过程中,样品固体发生分解的化学方程式是
(2)曲线B段所表示物质的化学式是
您最近一年使用:0次