(1)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,该物质中存在的化学键有离子键、_______ 和_______ ;含有的Fe3+的核外电子排布式为_______________ 。
(2)KCN 可被H2O2氧化为KOCN
①KOCN 可作为制药原料,其晶体类型是__________ ;碳原子采取sp杂化,1mol该物质中含有的π键数目为___________ 。含有的三种非金属元素的电负性由大到小的顺序是________ 。②H2O2常温下是液体,沸点较高(150℃),其主要原因是____________ 。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As 原子的杂化方式为____ ,雌黄和SnCl2 在盐酸中反应转化为雌黄(As4S4) 和SnCl4,SnCl4分子的空间构型为_______ 。
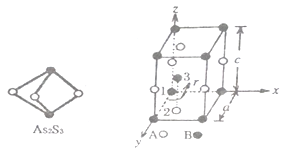
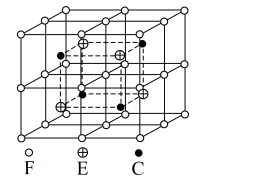
(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为______________ ,该晶胞参数分别为apm,cpm,γ=120°如图示;1号原子坐标为(0,0,0),2 号原子坐标为(1/3,2/3,0),则3号原子坐标为____________ ,计算上述晶体中A和B 两原子间的最小核间距为________ pm。
(2)KCN 可被H2O2氧化为KOCN
①KOCN 可作为制药原料,其晶体类型是
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As 原子的杂化方式为

(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为
更新时间:2018-01-30 19:12:33
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是元素周期表中原子半径最小的元素;Y元素基态原子有三个能级上有电子,且每个能级上的电子数相等;Z元素基态原子的单电子数在同周期元素基态原子中最多;W与Z同周期,第一电离能比Z的低;R与Y同主族;Q的最外层只有一个电子,其他电子层均有2n2个电子(n表示电子层序数)。请回答下列问题:
(1)Q的核外电子排布式为___ 。
(2)化合物X2W2中W的杂化方式为___ ;ZW2-的空间构型为___ 。
(3)Y、R的最高价氧化物中沸点较高的是___ (填化学式),原因是___ 。
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为___ ,Y原子的配位数为___ ,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏加 德罗常数的值NA为___ (用含a和ρ的代数式表示)。
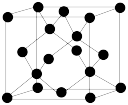
(1)Q的核外电子排布式为
(2)化合物X2W2中W的杂化方式为
(3)Y、R的最高价氧化物中沸点较高的是
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】黄血盐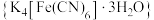 是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠
是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠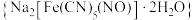 、赤血盐
、赤血盐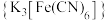 等。
等。
(1)基态铁原子核外电子排布式为_______ 。
(2)赤血盐中主族元素的电负性由大到小的顺序为_______ 。
(3)比较中心金属离子半径大小:黄血盐_______ 赤血盐(填“>”或“<”)。
(4)已知硝普钠和黄血盐的中心金属离子半径相等,硝普钠中铁的配位数是_______ ,配体为CN-、_______ 。
(5)碘酸钾也是一种食盐添加剂,其阴离子碘酸根( )的中心原子的杂化方式为
)的中心原子的杂化方式为_______ , 的空间构型是
的空间构型是_______ 。
(6)赤血盐与Fe2+反应可生成蓝色沉淀滕氏蓝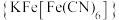 。滕氏蓝晶体中含有的作用力包括
。滕氏蓝晶体中含有的作用力包括_______ (填标号)。
A.极性共价键 B.非极性共价键 C.离子键 D.金属键 E.氢键
(7)滕氏蓝的晶胞由8个如图所示的小立方体构成(K+未标出)。
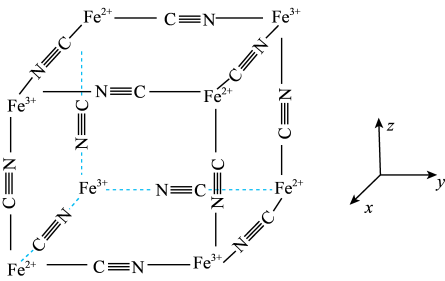
①已知K+位于小立方体的体心,但不是每个小立方体的体心都含有K+。根据化学式推断,一个滕氏蓝晶胞中含有的K+的个数为_______ 。
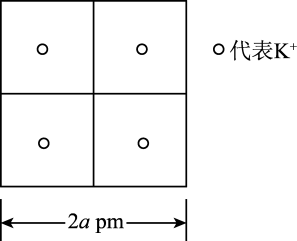
②滕氏蓝的晶胞沿x、y或z轴任意一个方向投影的K+的位置如图所示。晶胞中两个K+之间的最短距离为_______ pm,滕氏蓝晶体的密度为_______ g/cm3(列出计算式)。(已知:滕氏蓝的式量为Mr,阿伏加德罗常数的值为NA)
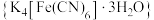 是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠
是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠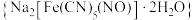 、赤血盐
、赤血盐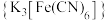 等。
等。(1)基态铁原子核外电子排布式为
(2)赤血盐中主族元素的电负性由大到小的顺序为
(3)比较中心金属离子半径大小:黄血盐
(4)已知硝普钠和黄血盐的中心金属离子半径相等,硝普钠中铁的配位数是
(5)碘酸钾也是一种食盐添加剂,其阴离子碘酸根(
 )的中心原子的杂化方式为
)的中心原子的杂化方式为 的空间构型是
的空间构型是(6)赤血盐与Fe2+反应可生成蓝色沉淀滕氏蓝
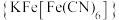 。滕氏蓝晶体中含有的作用力包括
。滕氏蓝晶体中含有的作用力包括A.极性共价键 B.非极性共价键 C.离子键 D.金属键 E.氢键
(7)滕氏蓝的晶胞由8个如图所示的小立方体构成(K+未标出)。

①已知K+位于小立方体的体心,但不是每个小立方体的体心都含有K+。根据化学式推断,一个滕氏蓝晶胞中含有的K+的个数为
②滕氏蓝的晶胞沿x、y或z轴任意一个方向投影的K+的位置如图所示。晶胞中两个K+之间的最短距离为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:
(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为CO2和H2O。
①基态钴原子的核外电子排布式为[Ar]_______ 。
②甲醛分子中三种元素电负性由大到小的顺序为_______ (填元素符号);甲醛分子的立体构型为_______ ;分子中σ键与π键数目比为_______ 。
(2)[Co(NH3)6]Cl3是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是_______ ,NH3分子中氮原子的杂化轨道类型为_______ ,NH3是_______ (填“极性”或“非极性”)分子。
(3)LiCoO2可用作锂离子电池的电极材料。在元素周期表中,与Li的化学性质最相似的邻族元素是_______ (填元素符号),该元素基态原子核外M层电子的自旋状态_______ (填“相同”或“相反”);LiF的熔点为848℃,属于_______ 晶体,LiF的熔点高于LiCl熔点(605℃)的原因是_______ 。
(4)某钻化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图所示,已知晶胞参数为a nm,则此晶体的密度为(列出计算式即可)_______ g·cm-3。
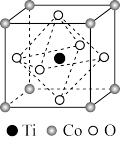
(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为CO2和H2O。
①基态钴原子的核外电子排布式为[Ar]
②甲醛分子中三种元素电负性由大到小的顺序为
(2)[Co(NH3)6]Cl3是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
(3)LiCoO2可用作锂离子电池的电极材料。在元素周期表中,与Li的化学性质最相似的邻族元素是
(4)某钻化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图所示,已知晶胞参数为a nm,则此晶体的密度为(列出计算式即可)

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______ ,其核外共有______ 种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________ (用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____ 、_____ 。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____ ,HCN分子的空间构型为____________ 。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为_________ ,每个Si原子被_______ 个最小环所共有。
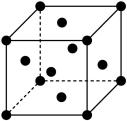
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____ mol-1。
(1)铁离子(Fe3+)最外层电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

(1)1mol化合物I含有___________ mol σ键。
(2)基态硫原子价层电子排布式为___________ 。
(3)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(4)汞的原子序数为80,位于元素周期表第___ 周期第IIB族。
(5)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___ 。
A.在I中S原子采取sp3杂化 B.在II中S元素的电负性最大
C.在III中C-C-C键角是180° D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是___________ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为___________ ;该晶胞中粒子个数比Hg:Ge:Sb =___________ 。
③设X的最简式的式量为Mr,则X晶体的密度为_____ g/cm3(设NA为阿伏加德罗常数的值)。

(1)1mol化合物I含有
(2)基态硫原子价层电子排布式为
(3)H2S、CH4、H2O的沸点由高到低顺序为
(4)汞的原子序数为80,位于元素周期表第
(5)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在II中S元素的电负性最大
C.在III中C-C-C键角是180° D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的式量为Mr,则X晶体的密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大。A、C原子2p能级上均有两个未成对电子,EC2与BC2-为等电子体,D基态原子有11种运动状态的电子,F是第四周期未成对电子最多的原子。请回答下列问题:
(1)上述元素中第一电离能最大的是__ (填元素符号)。A基态原子的电子排布式是__ ,E在周期表中的位置是第__ 周期__ 族。
(2)科学家成功地在高压下将AC2转化为具有空间立体网状结构的晶体,该晶体中A的杂化轨道类型是__ 。
(3)D+、AB-、F6+三种离子组成的化合物D3F(AB)6,其中化学键的类型有__ ,该化合物中存在一个复杂离子,该离子的化学式为__ 。
(4)“酒精检测仪”中有红色FC3和少量H2SO4,检测酒驾时反应的化学方程式为___ 。
(1)上述元素中第一电离能最大的是
(2)科学家成功地在高压下将AC2转化为具有空间立体网状结构的晶体,该晶体中A的杂化轨道类型是
(3)D+、AB-、F6+三种离子组成的化合物D3F(AB)6,其中化学键的类型有
(4)“酒精检测仪”中有红色FC3和少量H2SO4,检测酒驾时反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态16N中,其s能电子云形状是_____ 形的,其p能级轨道上存在______ 个自旋方向相同的电子;CN-中共价键的类型有______ 。
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是_______ (填名称)。
(3)化合物(CH3)3N能溶于水,其原因是_______________ ,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为__________________ .。
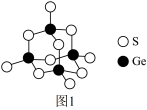
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示,则S原子的杂化轨道类型是______ ,阴离子A的化学式为______ 。

(5)立方氮化硼的晶胞如图2所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为______ ;若晶胞边长为acm,则立方氮化硼的密度是______ g·cm-3(只要求列算式,阿伏伽德罗常数用NA表示)。
(1)在基态16N中,其s能电子云形状是
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是
(3)化合物(CH3)3N能溶于水,其原因是
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示,则S原子的杂化轨道类型是


(5)立方氮化硼的晶胞如图2所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
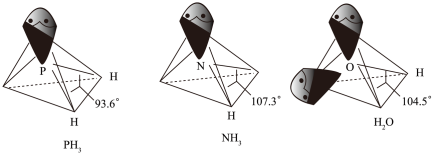
 中P的杂化类型是
中P的杂化类型是_______ 。 的沸点比
的沸点比 的
的_______ ,原因是_______ , 的键角小于
的键角小于 的,分析原因
的,分析原因_______ 。
(4)在金属材料中添加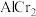 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。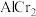 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是_______ 原子。设Cr和Al原子半径分别为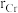 和
和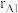 ,则金属原子空间占有率为
,则金属原子空间占有率为_______ %(列出计算表达式)。

 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的,分析原因
的,分析原因(4)在金属材料中添加
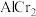 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。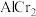 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是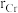 和
和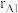 ,则金属原子空间占有率为
,则金属原子空间占有率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】现有 A、B、C、D、E、F六种原子序数依次增大的前四周期元素的原子,其中A在周期表中原子半径最小,光化学烟雾与B的氧化物有关,C的最高价氧化物具有两性,D的原子半径在同周期中最小(稀有气体除外),E位于周期表中第七列,F的最外层只有一个电子。
(1)写出E的价层电子排布式___________ ,BA3的中心原子的杂化方式为___________ 。
(2)已知CD3在453K时就能升华,则其晶体为___________ 晶体;实验研究表明,其蒸气存在二聚体,请写出其二聚体的结构式___________ 。
(3)已知CoD3与BA3可形成多种化合物,如CoD3•6BA3、CoD3•5BA3、CoD3•4BA3;将1mol三种化合物溶于水,然后向三种溶液中加入足量的硝酸银溶液,立即产生氯化银沉淀,其物质的量分别为3、2、1mol。请根据实验事实用配合物的形式写出CoD3•5BA3的化学式___________ ,其中心离子提供的空轨道数为___________ 。
(4)现已发现很多种具有形状记忆效应的合金,其中一种具有磁性形状记忆的合金由C、E、F组成,其晶胞如图所示,其化学式为___________ ,设其晶胞边长为a nm,其密度为___________ g·cm-3.(列出计算表达式)
(1)写出E的价层电子排布式
(2)已知CD3在453K时就能升华,则其晶体为
(3)已知CoD3与BA3可形成多种化合物,如CoD3•6BA3、CoD3•5BA3、CoD3•4BA3;将1mol三种化合物溶于水,然后向三种溶液中加入足量的硝酸银溶液,立即产生氯化银沉淀,其物质的量分别为3、2、1mol。请根据实验事实用配合物的形式写出CoD3•5BA3的化学式
(4)现已发现很多种具有形状记忆效应的合金,其中一种具有磁性形状记忆的合金由C、E、F组成,其晶胞如图所示,其化学式为

您最近一年使用:0次



