消毒剂在生产生活中有极其重要的作用。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量上述物质消毒效率最高的是________ (填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(2)H2O2可作为废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为_______________________ ,H2O2被称为“绿色氧化剂”的理由是____________________________ 。
(3)漂白剂亚氯酸钠(NaClO2)在常温、黑暗处可保存一年。亚氯酸不稳定,可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________ 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______ (用离子方程式表示)。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量上述物质消毒效率最高的是
A.Cl2 B.H2O2 C.ClO2 D.O3
(2)H2O2可作为废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(3)漂白剂亚氯酸钠(NaClO2)在常温、黑暗处可保存一年。亚氯酸不稳定,可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是
更新时间:2018-12-03 17:52:04
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】已知:还原性I->Fe2+>Br-。向含有1molFeI2和2molFeBr2的溶液中通入一定量的Cl2。
(1)若通入2molCl2,此时被氧化的离子是____ ,被氧化的离子的物质的量分别是_____ 。
(2)若通入3molCl2,则被氧化的离子是____ ,对应氧化产物的物质的量分别是_____ 。
(1)若通入2molCl2,此时被氧化的离子是
(2)若通入3molCl2,则被氧化的离子是
您最近一年使用:0次
【推荐2】《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种核素的比例确定“北京人”生存年代的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)26Al和27Al_______(选填编号)。
(2)自然界一共存在三种硅的稳定同位素,分别是28Si、29Si和30Si。
①Si原子的结构示意图为_______ 。
②计算硅元素的近似相对原子质量的计算式为;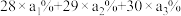 ,其中a1%、a2%……是指各同位素的
,其中a1%、a2%……是指各同位素的_______ 。
(3)向盐酸中逐滴滴加硅酸钠溶液,当pH达到6~7时得到一种乳白色、半透明的分散系,其分散质为粒径在5~100 nm的SiO2·nH2O粒子。该分散系属于_______ (选填“溶液”“浊液”或“胶体”),简单的证明方法是_______ 。
(4)已知硫化氢气体可以使酸性高锰酸钾溶液褪色。
①用单线桥法标出电子转移的方向和数目_______ 。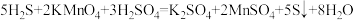
②氧化产物是_______ ,被还原的元素为_______ 。
③若11.2 L(标准状况下)H2S气体完全反应,则反应中转移电子个数为_______ (用NA表示阿伏加德罗常数)
④该反应中氧化剂和还原剂的物质的量之比为_______ 。
(1)26Al和27Al_______(选填编号)。
| A.是同一种元素 | B.是同一种核素 |
| C.具有相同的中子数 | D.具有相同的化学性质 |
①Si原子的结构示意图为
②计算硅元素的近似相对原子质量的计算式为;
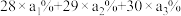 ,其中a1%、a2%……是指各同位素的
,其中a1%、a2%……是指各同位素的(3)向盐酸中逐滴滴加硅酸钠溶液,当pH达到6~7时得到一种乳白色、半透明的分散系,其分散质为粒径在5~100 nm的SiO2·nH2O粒子。该分散系属于
(4)已知硫化氢气体可以使酸性高锰酸钾溶液褪色。
①用单线桥法标出电子转移的方向和数目
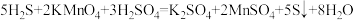
②氧化产物是
③若11.2 L(标准状况下)H2S气体完全反应,则反应中转移电子个数为
④该反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-的物质的量分数(α)随pH变化的关系如图所示。
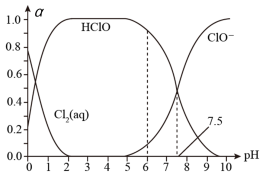
由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果强的是pH为___________ ,当pH=7.5时,氯水中含氯元素的微粒有___________ 。
(2)Ca(ClO)2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,NaClO2中Cl元素的化合价为___________ ,写出工业上用氯气与石灰乳反应生产漂白粉的化学方程式:___________ 。
(3)ClO2是国际上公认的高效、安全的杀菌消毒剂。
①工业制备ClO2的反应原理为:2KClO3+H2C2O4+H2SO4=K2SO4+2ClO2+2X+2H2O,X的化学式为___________ ,每生成1mol ClO2,反应中转移电子___________ mol。
②消毒能力可用单位质量消毒剂得电子多少来衡量。则ClO2与Cl2消毒能力比为___________ (整数比)。二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型水处理剂可用于城市自来水的处理。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(4)工业上以CH3OH和NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体。已知该反应分两步进行,第一步反应为2ClO +2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①第二步反应为___________ (写离子方程式)。
②工业生产时,需在反应物中加入少量Cl-,其作用是___________ 。
③生产中会发生副反应ClO +Cl−+H+→Cl2↑+H2O (未配平)若测得反应后的混合气体中Cl2的体积分数为
+Cl−+H+→Cl2↑+H2O (未配平)若测得反应后的混合气体中Cl2的体积分数为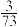 ,则起始投料时CH3OH与NaClO3的物质的量之比为
,则起始投料时CH3OH与NaClO3的物质的量之比为___________ 。
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-的物质的量分数(α)随pH变化的关系如图所示。

由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果强的是pH为
(2)Ca(ClO)2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,NaClO2中Cl元素的化合价为
(3)ClO2是国际上公认的高效、安全的杀菌消毒剂。
①工业制备ClO2的反应原理为:2KClO3+H2C2O4+H2SO4=K2SO4+2ClO2+2X+2H2O,X的化学式为
②消毒能力可用单位质量消毒剂得电子多少来衡量。则ClO2与Cl2消毒能力比为
(4)工业上以CH3OH和NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体。已知该反应分两步进行,第一步反应为2ClO
 +2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。①第二步反应为
②工业生产时,需在反应物中加入少量Cl-,其作用是
③生产中会发生副反应ClO
 +Cl−+H+→Cl2↑+H2O (未配平)若测得反应后的混合气体中Cl2的体积分数为
+Cl−+H+→Cl2↑+H2O (未配平)若测得反应后的混合气体中Cl2的体积分数为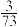 ,则起始投料时CH3OH与NaClO3的物质的量之比为
,则起始投料时CH3OH与NaClO3的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】写出下列反应的离子方程式。
(1)硫酸溶液与金属锌的反应___ ;
(2)CuSO4溶液中加入Ba(OH)2溶液___ ;
(3)盐酸溶液与氧化钙的反应___ ;
(4)钠与水的反应___ ;
(5)氯气与NaOH溶液的反应___ ;
(6)CO2通入澄清石灰水使石灰水变浑浊___ 。
(1)硫酸溶液与金属锌的反应
(2)CuSO4溶液中加入Ba(OH)2溶液
(3)盐酸溶液与氧化钙的反应
(4)钠与水的反应
(5)氯气与NaOH溶液的反应
(6)CO2通入澄清石灰水使石灰水变浑浊
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】将含有少量 的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),据此回答下列问题:
的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),据此回答下列问题:
(1)写出生成漂白粉的化学方程式是_______ 。
(2)此实验所得 产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
①温度较高时氯气与消石灰反应生成了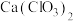 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ ;如图为反应后溶液中 、
、 离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。
离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。

a.图中曲线Ⅰ表示_______ 离子的物质的量随反应时间变化的关系。
b.所用石灰乳中含有 的物质的量为
的物质的量为_______  。
。
c.另取一份含有等物质的量 的石灰乳,以较大的速率通入足量氯气,反应后测得产物中
的石灰乳,以较大的速率通入足量氯气,反应后测得产物中 的物质的量为
的物质的量为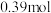 ,则产物中
,则产物中
_______ 。
②试判断另一个副反应是_______ (写出此反应的化学方程式);为避免此副反应发生,可以采取的改进措施是_______ 。
 的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),据此回答下列问题:
的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),据此回答下列问题:(1)写出生成漂白粉的化学方程式是
(2)此实验所得
 产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。①温度较高时氯气与消石灰反应生成了
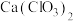 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是 、
、 离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。
离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。
a.图中曲线Ⅰ表示
b.所用石灰乳中含有
 的物质的量为
的物质的量为 。
。c.另取一份含有等物质的量
 的石灰乳,以较大的速率通入足量氯气,反应后测得产物中
的石灰乳,以较大的速率通入足量氯气,反应后测得产物中 的物质的量为
的物质的量为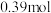 ,则产物中
,则产物中
②试判断另一个副反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】化学实验的微型化可有效减少污染,实现化学实验的绿色化。某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0. 1 mol/L的KBr、KI(含淀粉)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
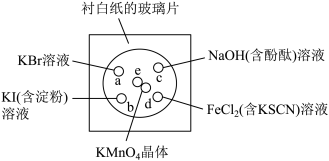
(1)e处发生反应的离子方程式为___________ ,该反应中氧化剂和还原剂的物质的量之比为___________
(2)b处的实验现象为___________ ,d处的实验现象为___________ 。
(3)c处反应的化学方程式为___________ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为___________ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?___________ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是___________ 。

(1)e处发生反应的离子方程式为
(2)b处的实验现象为
(3)c处反应的化学方程式为
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
您最近一年使用:0次



