下列生产、生活等实际应用,能用勒夏特列原理解释的是
| A.加入催化剂有利于合成氨的反应 |
| B.500 ℃比室温更有利于合成氨的反应(已知合成氨反应是放热反应) |
| C.由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 |
| D.阴暗处密封有利于氯水的储存 |
更新时间:2018-12-06 11:09:31
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已达到平衡的下列可逆反应中,增大压强(缩小体积),体系的颜色不变深的是( )
A.2NO2(g)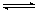 N2O4(g) N2O4(g) |
B.FeCl3(ag)+3KSCN(ag) 3KCl(ag)+Fe(SCN)3(ag) 3KCl(ag)+Fe(SCN)3(ag) |
C.2NO2(g)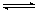 2NO(g)+O2(g) 2NO(g)+O2(g) |
D.2HBr(g)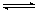 H2(g)+Br2(g) H2(g)+Br2(g) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】某小组进行实验,向10mL蒸馏水中加入0.4gI2,充分振荡,溶液呈浅棕色,再加入0.2gZn粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知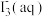 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
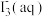 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 | I2在水中溶解度较小 |
| B | 溶液颜色加深 | 生成ZnI2的速率大于生成 的速率 的速率 |
| C | 紫黑色晶体消失 | 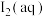 的消耗使溶解平衡 的消耗使溶解平衡 正移 正移 |
| D | 溶液褪色 | Zn使I2和 全部转化为I- 全部转化为I- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



