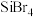KIO3是一种重要的无机化合物,可作食盐中的补碘剂。回答下列问题
(1)基态K原子中核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为_________ 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr的低原因是________________________________ 。
(2)K+与C1-具有相同的电子构型,r(K+)小于r(Cl-),原因是____________________________ 。
(3)KIO3中阴离子的空间构型是__________ ,中心原子的杂化形式为___________ 。
(4)由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实能够说明这个结论的是______________________________ (填序号)
A.已经制得了IBr、ICl等卤素互化物和I2O5等碘的氧化物
B.已经制得了I(NO3)3、I(ClO4)3·H2O等含I3+离子的化合物
C.碘易溶于KI等碘化物溶液,形成I3-离子
D.I4O9是一种碘酸盐
(5)KIO3晶体是一种性能良好的非线性光学材料具有钙钛矿型的立体结构,边长为anm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。与K紧邻的O个数为_______ 。已知阿伏伽德罗常数的值为NA,则KIO3的密度为_______ (列式表示)g·cm-3。
(6)若KIO3晶胞中处于左下角顶角的K原子的坐标参数为(0,0,0),位于下底面面心位置的O原子的坐标参数为( ,
, ,0),在KIO3晶胞结构的另一种表示中,I处于各顶角位置,设左下角顶角的I原子的坐标参数为(0,0,0),则K原子的坐标参数为
,0),在KIO3晶胞结构的另一种表示中,I处于各顶角位置,设左下角顶角的I原子的坐标参数为(0,0,0),则K原子的坐标参数为____________ 。
(1)基态K原子中核外电子占据的最高能层的符号是
(2)K+与C1-具有相同的电子构型,r(K+)小于r(Cl-),原因是
(3)KIO3中阴离子的空间构型是
(4)由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实能够说明这个结论的是
A.已经制得了IBr、ICl等卤素互化物和I2O5等碘的氧化物
B.已经制得了I(NO3)3、I(ClO4)3·H2O等含I3+离子的化合物
C.碘易溶于KI等碘化物溶液,形成I3-离子
D.I4O9是一种碘酸盐
(5)KIO3晶体是一种性能良好的非线性光学材料具有钙钛矿型的立体结构,边长为anm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。与K紧邻的O个数为

(6)若KIO3晶胞中处于左下角顶角的K原子的坐标参数为(0,0,0),位于下底面面心位置的O原子的坐标参数为(
 ,
, ,0),在KIO3晶胞结构的另一种表示中,I处于各顶角位置,设左下角顶角的I原子的坐标参数为(0,0,0),则K原子的坐标参数为
,0),在KIO3晶胞结构的另一种表示中,I处于各顶角位置,设左下角顶角的I原子的坐标参数为(0,0,0),则K原子的坐标参数为
更新时间:2018-12-18 15:08:59
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途。
(1)基态砷原子的核外电子排布式为________。氮、磷、砷的第一电离能顺序为__________>__________>__________(填元素符号)。
(2)已知N2O为直线形结构,结构式为N=N=O。则N2O是__________(填“极性”或“非极性”)分子。中间的氮原子的杂化轨道类型为__________杂化。
(3)已知下列数据:
NH3的熔、沸点均高于PH3的原因是__________;PH3的分解温度高于其沸点,其原因是__________。
(4)根据价层电子对互斥理论,氨分子中的键角__________(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为__________。
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是__________。
②该晶体中__________(填“是”或“否”)存在配位键。
(1)基态砷原子的核外电子排布式为________。氮、磷、砷的第一电离能顺序为__________>__________>__________(填元素符号)。
(2)已知N2O为直线形结构,结构式为N=N=O。则N2O是__________(填“极性”或“非极性”)分子。中间的氮原子的杂化轨道类型为__________杂化。
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
NH3的熔、沸点均高于PH3的原因是__________;PH3的分解温度高于其沸点,其原因是__________。
(4)根据价层电子对互斥理论,氨分子中的键角__________(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为__________。
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是__________。
②该晶体中__________(填“是”或“否”)存在配位键。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜及其化合物在生活和生产中有着广泛的应用。回答下列问题:
(1)基态铜原子价层电子排布式为_____ ,基态铜原子____ 种运动状态不相同的电子。
(2)单质铜是由____ 键形成的晶体。
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为_____ ,写出与 互为等电子体的一种分子或离子是
互为等电子体的一种分子或离子是______ 。
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: ;Cu2+的配位数为
;Cu2+的配位数为____ ,乙二胺沸点高于1,2﹣二氯乙烷(Cl-CH2-CH2-Cl)的主要原因是______ 。
(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。
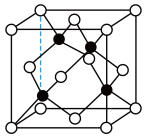
①该晶体的化学式为____ 。
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于___ (填“共价”或“离子”)化合物。
③已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为___ pm。
(1)基态铜原子价层电子排布式为
(2)单质铜是由
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为
 互为等电子体的一种分子或离子是
互为等电子体的一种分子或离子是②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
 ;Cu2+的配位数为
;Cu2+的配位数为(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于
③已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的
 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且有成单电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式_____________________ 。
(2)A的单质分子中π键的个数为___________ 。
(3)A元素、B元素和C三元素第一电离能由大到小的顺序为__________ (用元素符号表示)。
(4)B元素的氢化物的沸点是同族元素中最高的,原因是______________________ 。
(5)A的最简单氢化物分子的空间构型为_______ ,其中A原子的杂化类型是________ 。
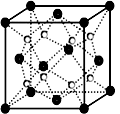
(6)C和D形成的化合物的晶胞结构如下图,已知晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________ cm。 (用含ρ、NA的计算式表示)
(1)写出基态E原子的价电子排布式
(2)A的单质分子中π键的个数为
(3)A元素、B元素和C三元素第一电离能由大到小的顺序为
(4)B元素的氢化物的沸点是同族元素中最高的,原因是
(5)A的最简单氢化物分子的空间构型为
(6)C和D形成的化合物的晶胞结构如下图,已知晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】硅和卤素单质反应可以得到 。
。
 的熔沸点
的熔沸点
(1)①沸点依次升高的原因是______ ,②气态 分子的空间构型是
分子的空间构型是______ ;
(2) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。 中P的杂化类型是
中P的杂化类型是______ 。
② 的沸点比
的沸点比 的
的______ (高或者低),原因是______ 。
(3)① 的空间构型为
的空间构型为______ (用文字描述);抗坏血酸的分子结构如图乙所示,分子中碳原子的轨道杂化类型为②______ ;③推测抗坏血酸在水中的溶解性______ (填“难溶于水”或“易溶于水”)。
 。
。 的熔沸点
的熔沸点
|
|
|
| |
熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(1)①沸点依次升高的原因是
 分子的空间构型是
分子的空间构型是(2)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。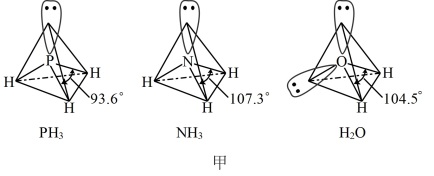
 中P的杂化类型是
中P的杂化类型是②
 的沸点比
的沸点比 的
的(3)①
 的空间构型为
的空间构型为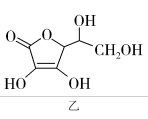
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
真题
解题方法
【推荐2】锰氧化物具有较大应用价值,回答下列问题:
(1) 在元素周期表中位于第
在元素周期表中位于第_______ 周期_______ 族;同周期中,基态原子未成对电子数比 多的元素是
多的元素是_______ (填元素符号)。
(2) 如某种氧化物
如某种氧化物 的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为
的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为_______ 。 晶体有O原子脱出时,出现O空位,
晶体有O原子脱出时,出现O空位, 的化合价
的化合价_______ (填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是_______ (填标号)。
A. B.
B. C.
C. D.
D.
(3)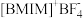 (见图)是
(见图)是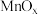 晶型转变的诱导剂。
晶型转变的诱导剂。 的空间构型为
的空间构型为_______ ;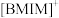 中咪唑环存在
中咪唑环存在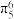 大
大 键,则N原子采取的轨道杂化方式为
键,则N原子采取的轨道杂化方式为_______ 。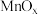 可作
可作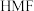 转化为
转化为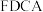 的催化剂(见下图)。
的催化剂(见下图)。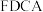 的熔点远大于
的熔点远大于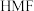 ,除相对分子质量存在差异外,另一重要原因是
,除相对分子质量存在差异外,另一重要原因是_______ 。
(1)
 在元素周期表中位于第
在元素周期表中位于第 多的元素是
多的元素是(2)
 如某种氧化物
如某种氧化物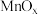 的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为
的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为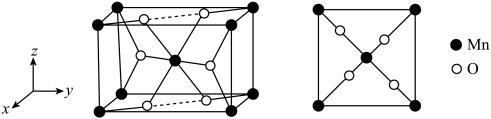
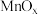 晶体有O原子脱出时,出现O空位,
晶体有O原子脱出时,出现O空位, 的化合价
的化合价A.
 B.
B. C.
C. D.
D.
(3)
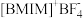 (见图)是
(见图)是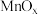 晶型转变的诱导剂。
晶型转变的诱导剂。 的空间构型为
的空间构型为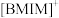 中咪唑环存在
中咪唑环存在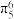 大
大 键,则N原子采取的轨道杂化方式为
键,则N原子采取的轨道杂化方式为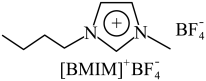
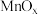 可作
可作 转化为
转化为 的催化剂(见下图)。
的催化剂(见下图)。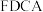 的熔点远大于
的熔点远大于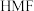 ,除相对分子质量存在差异外,另一重要原因是
,除相对分子质量存在差异外,另一重要原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】氮、磷、砷(As)均为第VA族元素。回答下列问题:
(1)元素周期表中,As是_______ 区元素, 基态As的价电子排布式为_______ 。 与P同周期且第一电离能大于磷元素的有_______ (写元素符 号)。
(2)隔夜的叶菜类熟菜不能食用,原因是其中的部分NO 在硝酸还原酶作用下转化为致癌的亚硝酸根离子NO
在硝酸还原酶作用下转化为致癌的亚硝酸根离子NO 。硝酸根离子NO
。硝酸根离子NO 中N原子的杂化方式为
中N原子的杂化方式为_______ 杂化,O3与NO 空间结构类似,O3分子的空间构型为
空间结构类似,O3分子的空间构型为_______ 。
(3)氢氰酸(HCN)可用于制造剧毒的氢氰酸盐毒药,HCN中σ键和π键个数比为_______ 。
(4)立方氮化硼(BN)质地非常坚硬,是超硬材料,可制成高速切割工具和地质勘探、石油钻探的钻头,其晶胞结构如图所示(黑球为B原子):

BN晶体中N原子的配位数是_______ 。若阿伏加德罗常数的值为NA,该晶体的密度为ρg·cm-3,则晶胞边长a=_______ pm(用含p和NA的最简式表示)。
(1)元素周期表中,As是
(2)隔夜的叶菜类熟菜不能食用,原因是其中的部分NO
 在硝酸还原酶作用下转化为致癌的亚硝酸根离子NO
在硝酸还原酶作用下转化为致癌的亚硝酸根离子NO 。硝酸根离子NO
。硝酸根离子NO 中N原子的杂化方式为
中N原子的杂化方式为 空间结构类似,O3分子的空间构型为
空间结构类似,O3分子的空间构型为(3)氢氰酸(HCN)可用于制造剧毒的氢氰酸盐毒药,HCN中σ键和π键个数比为
(4)立方氮化硼(BN)质地非常坚硬,是超硬材料,可制成高速切割工具和地质勘探、石油钻探的钻头,其晶胞结构如图所示(黑球为B原子):

BN晶体中N原子的配位数是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号),其中C原子的价电子排布图为_______ 。
(2)单质A有两种同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为_______ 和_______ 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为_______ ,中心原子的杂化轨道类型为_______ 。
(4) A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F 的化学式为_______ ;晶胞中A 原子的配位数为_______ ;列式计算晶体F的密度(g·cm-3)_______ 。(只需写出计算式,无需计算)

(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为
(4) A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F 的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】工业中可利用生产钛白的副产物 ,和硫铁矿(
,和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(1) 结构示意图如图:
结构示意图如图:

① 的价层电子排布式为
的价层电子排布式为___________ 。
② 中O和
中O和 中S杂化类型
中S杂化类型___________ (填“相同”或“不相同”),比较 中H-O-H键角和
中H-O-H键角和 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因___________ 。
③ 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是___________ 。
(2) 晶体的晶胞形状为立方体,边长为anm,结构如图:
晶体的晶胞形状为立方体,边长为anm,结构如图:

① 的配位数
的配位数___________ 个。
② 的摩尔质量为120
的摩尔质量为120 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,晶体的密度为
,晶体的密度为___________ 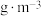 。
。
 ,和硫铁矿(
,和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(1)
 结构示意图如图:
结构示意图如图:
①
 的价层电子排布式为
的价层电子排布式为②
 中O和
中O和 中S杂化类型
中S杂化类型 中H-O-H键角和
中H-O-H键角和 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因③
 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是(2)
 晶体的晶胞形状为立方体,边长为anm,结构如图:
晶体的晶胞形状为立方体,边长为anm,结构如图:
①
 的配位数
的配位数②
 的摩尔质量为120
的摩尔质量为120 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,晶体的密度为
,晶体的密度为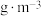 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铜及其化合物在生产生活中具有重要的应用。
(1)基态铜原子的价电子排布式为_______ 。与铜处于同一周期,且最外层电子数与铜原子相同的有_______ (填元素名称) 。
(2)铜锌合金俗称黄铜,铜锌两种金属的各级电离能(单位: )数据如下表。
)数据如下表。
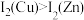 的原因是
的原因是_______ .
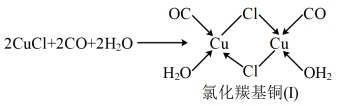
(3)利用 的盐酸溶液能吸收
的盐酸溶液能吸收 形成氯化羰基铜
形成氯化羰基铜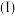 ,在
,在 过量时,可定量测定气体混合物中CO的含量,化学方程式为:
过量时,可定量测定气体混合物中CO的含量,化学方程式为:
相关元素的鲍林电负性数值见下表。
据此判断 中存在的化学键类型为
中存在的化学键类型为_______ (填“离子键”或“共价键”) 。
②CO的相对分子质量大于H2O的相对分子质量,H2O的沸点却远高于CO的沸点,原因是_______ 。
③氯化羰基铜(I)中Cl原子的杂化方式为_______ ;1mol氯化羰基铜中含有的 键数目
键数目_______ 。
(4)某种铜金合金的晶胞如下图所示.该合金的化学式可表示为_______ 。若Au原子在xy面上的投影如图2所示,请补充铜原子的投影图(用“●”表示) _______ ,若 表示阿伏加德罗常数的值,则晶体密度为
表示阿伏加德罗常数的值,则晶体密度为_______  (用含有d与
(用含有d与 的表达式表示) 。
的表达式表示) 。

(1)基态铜原子的价电子排布式为
(2)铜锌合金俗称黄铜,铜锌两种金属的各级电离能(单位:
 )数据如下表。
)数据如下表。 |  |  |  |  |  | |
 | 745.5 | 1957.9 | 3555 | 5536 | 7700 | 9900 |
 | 906.4 | 1733.3 | 3833 | 5731 | 7970 | 10400 |
 的原因是
的原因是(3)利用
 的盐酸溶液能吸收
的盐酸溶液能吸收 形成氯化羰基铜
形成氯化羰基铜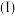 ,在
,在 过量时,可定量测定气体混合物中CO的含量,化学方程式为:
过量时,可定量测定气体混合物中CO的含量,化学方程式为:
相关元素的鲍林电负性数值见下表。
| 元素 | Cu | Cl | C | O | H |
| 电负性 | 1.9 | 3.0 | 2.5 | 3.5 | 2.1 |
 中存在的化学键类型为
中存在的化学键类型为②CO的相对分子质量大于H2O的相对分子质量,H2O的沸点却远高于CO的沸点,原因是
③氯化羰基铜(I)中Cl原子的杂化方式为
 键数目
键数目(4)某种铜金合金的晶胞如下图所示.该合金的化学式可表示为
 表示阿伏加德罗常数的值,则晶体密度为
表示阿伏加德罗常数的值,则晶体密度为 (用含有d与
(用含有d与 的表达式表示) 。
的表达式表示) 。
您最近一年使用:0次