元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm):
(1)离子半径大小:B3+_________ E2—;金属性A________ B(填>或<)
(2)D的单质和NaOH溶液反应的离子方程式___________________________________
(3)A的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为______ ;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是______ (填化学式);
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、−2 | +7、−1 | −2 |
(2)D的单质和NaOH溶液反应的离子方程式
(3)A的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是
更新时间:2019-03-29 11:18:07
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E元素同主族。
(1)B在元素周期表中的位置是_______ 。
(2)由A、B、C三种元素形成的离子化合物溶于水的电离方程式为_______ 。
(3)C、D、E形成的简单离子的半径大小关系是_______ (用离子符号表示)。
(4)用电子式表示化合物D2E的形成过程:_______ ,化合物D2C2的电子式_______ 。
(5)化合物D2C2与A2C反应的化学方程式_______ 。
(1)B在元素周期表中的位置是
(2)由A、B、C三种元素形成的离子化合物溶于水的电离方程式为
(3)C、D、E形成的简单离子的半径大小关系是
(4)用电子式表示化合物D2E的形成过程:
(5)化合物D2C2与A2C反应的化学方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_________________________ 。
(2)Fe成为阳离子时首先失去______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________ 。
(3)比较离子半径:F−__________ O2−(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________ ,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________ g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(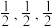 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为__________ 、__________ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)比较离子半径:F−
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
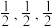 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
(1)Z元素位于周期表中第_ ______ 族,其基态原子的价层电子排布式为:______ ;
(2)T的一种化合物为 ,该分子中极性键和非极性键的数目之比为
,该分子中极性键和非极性键的数目之比为 ______ ,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
(3)W、X和Y三种元素中,第一电离能最小的为______ (填元素符号);W、X和Y的简单离子的半径从小到大的顺序为 ______ (用离子符号表示)。
(4)Z与水蒸气反应的化学方程式为:_____ 。
元素符号 | 元素性质或原子结构 |
T | 其一种无色氧化物遇空气变为红棕色 |
W | 其单质和化合物的焰色反应焰色均呈黄色 |
X | 基态原子的最外层电子排布式为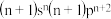 |
Y | 单质常温下为气体,可用于自来水消毒 |
Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为
 ,该分子中极性键和非极性键的数目之比为
,该分子中极性键和非极性键的数目之比为 (3)W、X和Y三种元素中,第一电离能最小的为
(4)Z与水蒸气反应的化学方程式为:
您最近一年使用:0次
【推荐1】A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:_______ B:_______ G_______ ,写出元素B的基态原子的轨道表示式(电子排布图):_______ 。
(2)C、D、E三种元素的原子半径由大到小的顺序_______ 。
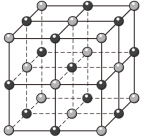
(3)D和F形成化合物的化学式为_______ ,在其晶胞中(如图)每个D离子周围紧邻且等距离的D离子有_______ 个,每个D离子周围紧邻且等距离的F离子有_______ 个,若晶胞参数为a pm,则该晶体的密度为_______ g·cm-3。
(4)已知元素A、B形成的(AB)2链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为_______ 。
(5)元素G位于周期表的_______ 区,其价电子的排布式为:_______ ,该元素可形成G2+、G3+,其中较稳定的是G3+,原因是_______ 。
(6)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是_______ 化合物(填“离子”或“共价”)。推测M的最高价氧化物对应水化物_______ (填“能”或“不能”)与D的最高价氧化物对应水化物发生反应。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3S23P1 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)C、D、E三种元素的原子半径由大到小的顺序
(3)D和F形成化合物的化学式为

(4)已知元素A、B形成的(AB)2链状分子中所有原子都满足8电子稳定结构,则其分子中
 键与
键与 键之比为
键之比为(5)元素G位于周期表的
(6)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2-的结构示意图为___________ 。
(2)V、W、X的原子半径由小到大的顺序是______________________ 。
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________ 。
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________ 晶体。
(5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________ 。
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________ 。
(1)V2-的结构示意图为
(2)V、W、X的原子半径由小到大的顺序是
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于
(5)①Na2YO3溶液中离子浓度从大到小的顺序是
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】现有部分短周期元素的性质或原子结构如表:
回答下列问题:
(1)X的离子结构示意图为__ 。
(2)Z的简单气态氢化物的VSEPR模型为___ ,分子中的中心原子的杂化轨道类型为___ ,分子的空间结构为__ 。
(3)1个Z的单质分子中,含有__ 个σ键和__ 个π键。
(4)Y的最高价氧化物对应的水化物与KOH反应的化学方程式为__ 。
(5)元素T与氯元素相比,非金属性较强的是__ (填元素符号),下列表述中能证明这事实的是__ (填标号)。
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出氯气
c.氯与T形成的化合物中,氯元素呈正价
| 元素 | 元素性质或原子结构 |
| T | 2p轨道上有5个电子 |
| X | L层p能级电子数比s能级电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有3个未成对电子 |
回答下列问题:
(1)X的离子结构示意图为
(2)Z的简单气态氢化物的VSEPR模型为
(3)1个Z的单质分子中,含有
(4)Y的最高价氧化物对应的水化物与KOH反应的化学方程式为
(5)元素T与氯元素相比,非金属性较强的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出氯气
c.氯与T形成的化合物中,氯元素呈正价
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B、A与X均可形成10个电子化合物;B的最高价含氧酸可与其气态氢化物反应生成盐,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液先变红后褪色。
用元素符号或化学式回答下列问题。
(1)X在周期表中的位置是______________ ;
(2)化合物Y2X2的电子式为__________ ,它含有的化学键类型有_________ (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)X、Z的简单氢化物中沸点较高的是_______ (填化学式),原因是__________________ 。
(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:___________________ ;
(5)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:___________
用元素符号或化学式回答下列问题。
(1)X在周期表中的位置是
(2)化合物Y2X2的电子式为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)X、Z的简单氢化物中沸点较高的是
(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:
(5)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为___________________________ 。
(2)元素C与元素D以原子个数比为1∶1形成化合物Q,请写出Q的电子式为_______ 。
(3)用电子式表示化合物D2C的形成过程_____________________ 。
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W,化合物W中存在的化学键有____________________ 。
(5)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为____________ ,当转移电子为0.2 mol时,标准状况下反应产生气体_______________ L。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_____________ 。
(1)B在周期表中的位置为
(2)元素C与元素D以原子个数比为1∶1形成化合物Q,请写出Q的电子式为
(3)用电子式表示化合物D2C的形成过程
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W,化合物W中存在的化学键有
(5)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】已知W、X、Y、Z是短周期的四种元素,其相关信息与原子半径关系如表所示:
(1)W元素位于元素周期表第____________ 周期____________ 族,W与X形成化合物的化学式为____________ 。
(2)W、X、Z的简单离子半径由大到小的顺序为__________ (用离子符号表示)。
(3)实验室制备Y的最高价氧化物对应水化物的方法是____________________ (写出操作方法),Y的最高价氧化物与X的最高价氧化物对应水化物反应的离子方程式为______________________ 。
(4)Y、Z的最高价氧化物对应水化物的酸性由强到弱的顺序为____________________ 。
| 元素 | 相关信息 | 原子半径关系 |
| W | 其中一种核素的质量数为18,中子数为10 |  |
| X | 与Ne原子的核外电子数相差1 | |
| Y | 单质是一种常见的半导体材料 | |
| Z | 非金属性在同周期主族元素中最强 |
(2)W、X、Z的简单离子半径由大到小的顺序为
(3)实验室制备Y的最高价氧化物对应水化物的方法是
(4)Y、Z的最高价氧化物对应水化物的酸性由强到弱的顺序为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】现有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式为___________ 。
(2)B元素在周期表中的位置是___________ ;离子半径:B___________ A(填“大于”或“小于”)。
(3)C原子的电子排布图是___________ ,其原子核外有___________ 个未成对电子,能量最高的电子为___________ 轨道上的电子,其轨道呈___________ 形。
(4)D原子的电子排布式为___________ ,D-的结构示意图是___________ 。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___________ ;B的最高价氧化物对应的水化物与D的氢化物的水溶液反应的化学方程式为___________ 。
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | 与A同周期,其最高价氧化物的水化物呈两性 |
| C | 在空气中含量第二,在地壳中含量第一 |
| D | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为
(2)B元素在周期表中的位置是
(3)C原子的电子排布图是
(4)D原子的电子排布式为
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】X、Y、Z均为短周期元素,X元素的气态氢化物的水溶液滴入无色酚酞变红,Y元素的最外层电子数是次外层电子数的2倍,Z元素是短周期元素中原子半径最大的元素(He、Ne、Ar除外)。
(1)写出X的元素符号___________ ,其原子结构示意图为___________ 。
(2)元素Y的最简单氢化物的化学式___________ 。
(3)Z元素原子的质子数为___________ ,Z元素的最高价氧化物对应的水化物的电子式为___________ 。
(4)X元素最高价氧化物对应的水化物与氧化铝反应的离子方程式为___________ 。
(5)Y元素的最高价氧化物和Z元素的过氧化物发生氧化还原反应的化学方程式为___________ 。
(1)写出X的元素符号
(2)元素Y的最简单氢化物的化学式
(3)Z元素原子的质子数为
(4)X元素最高价氧化物对应的水化物与氧化铝反应的离子方程式为
(5)Y元素的最高价氧化物和Z元素的过氧化物发生氧化还原反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】短周期主族元素X、Y、Z、W的原子序数依次增加,X、Y、W位于不同周期,Z、W位于同主族。它们组成的一种无机物A的结构如图所示。回答下列问题:
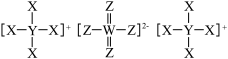
(1)Y在周期表的位置是_____ 。
(2)X和Y组成的最简单化合物的电子式为_____ 。
(3)A的水溶液呈_____ 性,用离子方程式表示其原因为_____ 。
(4)以铅蓄电池为电源,用直接电解法将污水中无机物A的阳离子转变为无污染的物质,其装置如下图所示:

Pt1电极接铅蓄电池_____ (填“正”或“负”)极,所接电极的电极材料为_____ ,污水中A的阳离子在电极上发生反应的电极反应式为_____ 。
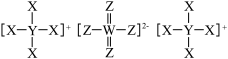
(1)Y在周期表的位置是
(2)X和Y组成的最简单化合物的电子式为
(3)A的水溶液呈
(4)以铅蓄电池为电源,用直接电解法将污水中无机物A的阳离子转变为无污染的物质,其装置如下图所示:

Pt1电极接铅蓄电池
您最近一年使用:0次



