近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_________________________ 。
(2)Fe成为阳离子时首先失去______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________ 。
(3)比较离子半径:F−__________ O2−(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________ ,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________ g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(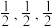 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为__________ 、__________ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)比较离子半径:F−
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
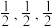 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
2019·全国·高考真题 查看更多[17]
(已下线)T35-物质结构与性质(已下线)专题20 结构与性质(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记安徽省六安市城南中学2021届高三上学期第一次月考化学试题四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升甘肃省兰州市第一中学2019-2020学年高二下学期4月月考化学试题西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题2020年闽粤赣三省十二校高三联合调研考试理综化学试题四川省泸州市泸县第二中学2020届高三上学期开学考试理综化学试题2019年全国统一考试化学试题(新课标Ⅱ)
更新时间:2019-06-09 11:40:50
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题:
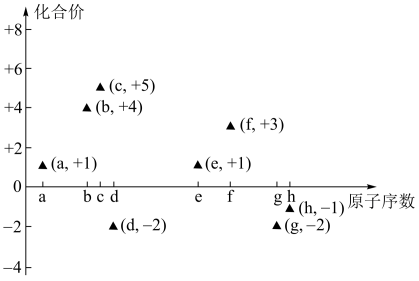
(1)b在元素周期表中的位置是_______ ;元素e和g组成的化合物的电子式为_______ 。
(2)d、f、g、h四种元素的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
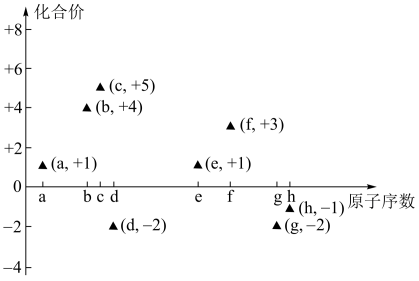
(1)b在元素周期表中的位置是
(2)d、f、g、h四种元素的简单离子半径由大到小的顺序为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】元素周期律(表)是认识元素化合物性质的重要理论。随着原子序数的递增,8种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如下图所示。
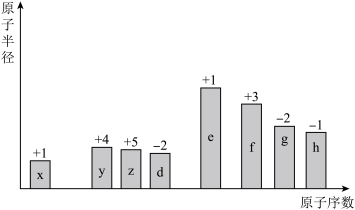
已知:x为非金属元素,d元素原子的最外层电子数为内层电子数的3倍。
(1)x、e、d三种元素形成的离子化合物的电子式为___________ 。化合物yd2中化学键类型有___________ (填“离子键”或“共价键”),
(2)f元素形成的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为___________ 。
(3)d、e简单离子的半径较大的是___________ (用化学式表示,下同);y、z的最高价氧化物的水化物的酸性较弱的是___________ ;d、g与x形成的化合物热稳定性较差的是___________ 。

已知:x为非金属元素,d元素原子的最外层电子数为内层电子数的3倍。
(1)x、e、d三种元素形成的离子化合物的电子式为
(2)f元素形成的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为
(3)d、e简单离子的半径较大的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】下表列出了第2到第4周期的9种元素在周期表中的位置:
请回答下列问题。
(1)9种元素中化学性质最不活泼的是(填元素符号,下同)___ , 金属性最强是___ 。
(2)A与F形成的一种化合物可作供氧剂,写出该化合物与二氧化碳反应的化学方程式:_________________________ 。
(3)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是________ 。
(4) A、C、D、G的简单离子中半径最小的是(填离子符号)__________ 。
(5)E与F形成原子个数比为1:2的化合物电子式__________ ,结构式___________ 。
(6)用电子式表示C与G组成的化合物的形成过程________________ 。
(7)能说明元素G非金属性比H非金属性强的实验事实是_________ (填字母序号)
a.G的氧化物对应水化物的酸性比H的氧化物对应的水化物的酸性强
b.G的单质与H2化合比H的单质与H2化合容易
c.G的单质能把H的简单离子从溶液中置换出来
d.G的气态氢化物的稳定性比H的气态氢化物的稳定性强
周期 | 主族和0族 | |||||||
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H | ||||||
(1)9种元素中化学性质最不活泼的是(填元素符号,下同)
(2)A与F形成的一种化合物可作供氧剂,写出该化合物与二氧化碳反应的化学方程式:
(3)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是
(4) A、C、D、G的简单离子中半径最小的是(填离子符号)
(5)E与F形成原子个数比为1:2的化合物电子式
(6)用电子式表示C与G组成的化合物的形成过程
(7)能说明元素G非金属性比H非金属性强的实验事实是
a.G的氧化物对应水化物的酸性比H的氧化物对应的水化物的酸性强
b.G的单质与H2化合比H的单质与H2化合容易
c.G的单质能把H的简单离子从溶液中置换出来
d.G的气态氢化物的稳定性比H的气态氢化物的稳定性强
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】王帅博士同美国加州大学伯克利分校化工系Enrique Iglesia教授在金属氧化物催化剂表面羟醛缩合反应机理方面的合作研究取得新进展。如图是羰基化合物的自缩合和交叉缩合途径:

回答下列问题:
(1)基态O原子核外有____________ 种不同运动状态的电子,与O元素同周期第一电离能大于O的主族元素有___________ (填元素符号)。
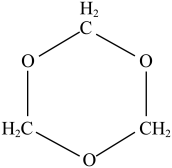
(2) HCHO和H2O都参与上述转化。HCHO分子的空间构型是________ ,三聚甲醛的结构如图所示,三聚甲醛中C原子的杂化方式为_____________ 。
(3)H2O能形成多种配位化合物。科研人员通过X射线推测胆矾中既含有配位键,又含有氢键。结构如图所示。胆矾的化学式用配位化合物的形式可表示为____ ,1mol胆矾所含σ键的数目为_________ NA。

(4)TiO2是上述转化的催化剂,CaTiO3是制取TiO2的一种原料,其晶胞结构如图所示。在CaTiO3晶体中,与某个钛离子距离最近且相等的其他钛离子共有________ 个,设该化合物的式量为M,密度为a g/cm3,阿伏加 德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为________ cm。


回答下列问题:
(1)基态O原子核外有
(2) HCHO和H2O都参与上述转化。HCHO分子的空间构型是

(3)H2O能形成多种配位化合物。科研人员通过X射线推测胆矾中既含有配位键,又含有氢键。结构如图所示。胆矾的化学式用配位化合物的形式可表示为

(4)TiO2是上述转化的催化剂,CaTiO3是制取TiO2的一种原料,其晶胞结构如图所示。在CaTiO3晶体中,与某个钛离子距离最近且相等的其他钛离子共有

您最近一年使用:0次
【推荐2】回答下列问题
(1)基态碘原子的价层电子的运动状态有_____ 种,基态Pb原子的价层电子排布式为_____ 。
(2) 价电子轨道表示式为
价电子轨道表示式为_____ ;
(3)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应。由硅原子核形成的三种微粒: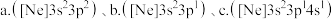 ,半径由大到小的顺序为
,半径由大到小的顺序为_____ (填标号);第三周期元素中,第一电离能介于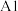 和P之间的元素有
和P之间的元素有_____ 种。
(4)下列状态的铁中,电离最外层一个电子所需能量最大的是_____ (填标号)。
 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为_____ 。
(6)原子发射光谱法是通过处于激发态的待测元素微粒回到基态时发射的特征谱线对其进行鉴别的方法。下列状态的铁粒子处于激发态的是_____(填标号)。
(1)基态碘原子的价层电子的运动状态有
(2)
 价电子轨道表示式为
价电子轨道表示式为(3)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应。由硅原子核形成的三种微粒:
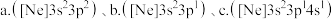 ,半径由大到小的顺序为
,半径由大到小的顺序为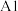 和P之间的元素有
和P之间的元素有(4)下列状态的铁中,电离最外层一个电子所需能量最大的是
a.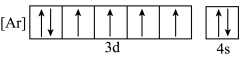
b.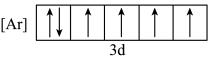
c.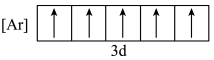
d.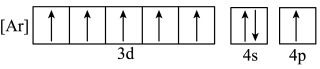
 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为(6)原子发射光谱法是通过处于激发态的待测元素微粒回到基态时发射的特征谱线对其进行鉴别的方法。下列状态的铁粒子处于激发态的是_____(填标号)。
A.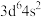 | B.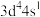 | C.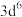 | D.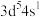 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】已知X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表:
请根据信息回答有关问题:
(1)元素Y的原子核外共有_____ 种不同运动状态的电子。
(2)基态X原子的核外电子轨道表示式为_____ ;X、Y、Z三种元素的非金属性由强到弱的排列次序依次为(写元素符号)_____ 。
(3)基态Q原子的核外电子排布式是_____ 。
(4)R的元素符号是_____ ,基态R原子的M电子层的电子排布式为_____ 。
(5)E有多种化合价,基态E2+的外围电子排布式是_____ 。
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 原子核外只有两个电子层,s电子数等于p电子数 |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有
(2)基态X原子的核外电子轨道表示式为
(3)基态Q原子的核外电子排布式是
(4)R的元素符号是
(5)E有多种化合价,基态E2+的外围电子排布式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Ⅰ.回答下列问题:
(1)利用价层电子对互斥模型推测分子或离子的空间结构。
 ;
;___________ ; (共价分子):
(共价分子):___________ 。
(2)有两种活性反应中间体,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的结构,写出相应的化学式。
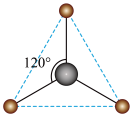
___________ ;
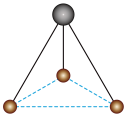
___________ 。
(3)按要求写出由第二周期非金属元素的原子构成的中性分子的化学式。
平面三角形分子:_______ ,三角锥形分子:________ ,正四面体形分子________ 。
Ⅱ.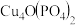 是锂—磷酸氧铜电池正极的活性物质,它可通过下列反应制备:
是锂—磷酸氧铜电池正极的活性物质,它可通过下列反应制备: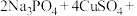
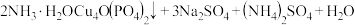 。
。
(4)写出基态 的电子排布式:
的电子排布式:___________ 。
(5) 的空间结构是
的空间结构是___________ 。
(6)P、S、N元素第一电离能由大到小的顺序为___________ 。
(7)氨基乙酸铜分子结构如下,其中碳原子的杂化方式为___________ ,基态碳原子核外电子有___________ 种运动状态。

(1)利用价层电子对互斥模型推测分子或离子的空间结构。
 ;
; (共价分子):
(共价分子):(2)有两种活性反应中间体,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的结构,写出相应的化学式。


(3)按要求写出由第二周期非金属元素的原子构成的中性分子的化学式。
平面三角形分子:
Ⅱ.
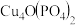 是锂—磷酸氧铜电池正极的活性物质,它可通过下列反应制备:
是锂—磷酸氧铜电池正极的活性物质,它可通过下列反应制备: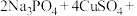
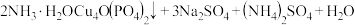 。
。(4)写出基态
 的电子排布式:
的电子排布式:(5)
 的空间结构是
的空间结构是(6)P、S、N元素第一电离能由大到小的顺序为
(7)氨基乙酸铜分子结构如下,其中碳原子的杂化方式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】填空。
(1)工业上采用向饱和食盐水中先后通入NH3和CO2的方式制取重要的化工原料纯碱。CO2的电子式是_______ ,分子中的键角为_______ ;NH3的结构式是_______ ,其分子构型为_______ 。两者中属于非极性分子的是_______ ,其所含化学键为_______ (填“极性”或“非极性”)键。
(2)氢化锂(LiH)是_______ (填“离子”或“共价”)化合物,写出其电子式_______ ,其构成微粒的半径大小关系为_______ (用微粒符号表示)。与同类型的NaH相比,_______ 的熔点高,理由是_______ 。
(3)实验数据表明,氯化铝在2.02×105Pa时熔点为190℃,且在180℃时开始升华。
①推测氯化铝是_______ (填“离子”或“共价”)化合物,导电性实验发现熔化的氯化铝不导电,氯化铝属于_______ (填“电解质”、“非电解质”或“既不是电解质也不是非电解质”)。
②实验测得氯化铝蒸气的密度折算成标准状况下为11.92g·L-1,则氯化铝的化学式为_______ 。
(1)工业上采用向饱和食盐水中先后通入NH3和CO2的方式制取重要的化工原料纯碱。CO2的电子式是
(2)氢化锂(LiH)是
(3)实验数据表明,氯化铝在2.02×105Pa时熔点为190℃,且在180℃时开始升华。
①推测氯化铝是
②实验测得氯化铝蒸气的密度折算成标准状况下为11.92g·L-1,则氯化铝的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。某离子液体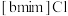 可与
可与 混合形成离子液体;
混合形成离子液体;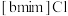 也可以转化成其他离子液体。如图是
也可以转化成其他离子液体。如图是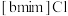 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程。
的流程。
(1) 中C原子的杂化方式为
中C原子的杂化方式为_______ , 的空间构型为
的空间构型为_______ 。
(2) 阳离子中的几种元素电负性由大到小的顺序为
阳离子中的几种元素电负性由大到小的顺序为_______ 。
(3)已知分子中的大π键可以用 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则 中五元环大π键可以表示为
中五元环大π键可以表示为_______ 。
(4) 熔点为
熔点为 熔点高于
熔点高于 ,原因是
,原因是_______ 。
(5) 和
和 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: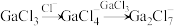 ,已知一个
,已知一个 中含有两个配位键,试画出
中含有两个配位键,试画出 的结构式:
的结构式:_______ 。
(6)室温氟穿梭电池的电解质为氟氢离子液体,含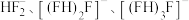 等离子,画出
等离子,画出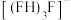 的结构式
的结构式_______ 。
(7)氟及其化合物的用途非常广泛,基于 设计的
设计的 循环如图所示:
循环如图所示:
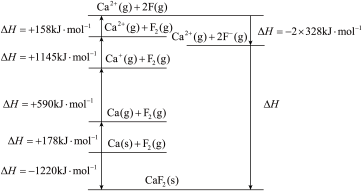
由图可知, 键的键能为
键的键能为_______  ;钙的第一电离能为
;钙的第一电离能为_______  。
。
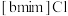 可与
可与 混合形成离子液体;
混合形成离子液体;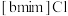 也可以转化成其他离子液体。如图是
也可以转化成其他离子液体。如图是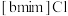 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程。
的流程。
(1)
 中C原子的杂化方式为
中C原子的杂化方式为 的空间构型为
的空间构型为(2)
 阳离子中的几种元素电负性由大到小的顺序为
阳离子中的几种元素电负性由大到小的顺序为(3)已知分子中的大π键可以用
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则 中五元环大π键可以表示为
中五元环大π键可以表示为(4)
 熔点为
熔点为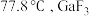 熔点高于
熔点高于 ,原因是
,原因是(5)
 和
和 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: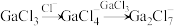 ,已知一个
,已知一个 中含有两个配位键,试画出
中含有两个配位键,试画出 的结构式:
的结构式:(6)室温氟穿梭电池的电解质为氟氢离子液体,含
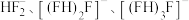 等离子,画出
等离子,画出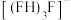 的结构式
的结构式(7)氟及其化合物的用途非常广泛,基于
 设计的
设计的 循环如图所示:
循环如图所示:
由图可知,
 键的键能为
键的键能为 ;钙的第一电离能为
;钙的第一电离能为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】过渡金属元素形成的物质有很多重要的用途。回答下列问题:
(1)基态锰原子的价层电子排布图(轨道表示式)为___________ 。
(2)与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的___________ 区。独立的 NH3分子中 H-N-H 的键角为 107.3º,[Zn(NH3)6]2+离子中 H-N-H 的键角___________ 107.3°(填“大于”、“小 于”或“等于”)。
(3)鉴定 Ni2+的特征反应如下所示:
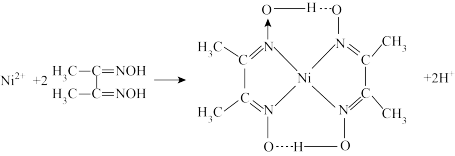
将丁二酮肟加入 Ni2+溶液中,生成一种鲜红色的二丁二酮肟合镍(Ⅱ)螯合物,在该螯合物中,碳原子的杂化方式是___________ ,组成该螯合物的第二周期元素第一电离能从大到小的顺序为___________ 。
(4)已知:r(Fe2+)为 61pm,r(Co2+)为 65pm。在隔绝空气条件下分别加热 FeCO3和 CoCO3,实验测得 FeCO3的分解温度低于 CoCO3,原因是___________ 。
(5)Ni 可以形成多种氧化物,其中一种 NiaO 晶体晶胞结构为 NaCl 型,由于晶体缺陷,a 的值为 0. 88,且晶体中的 Ni 分别为 Ni2+、Ni3+,则晶体中 Ni2+与 Ni3+的最简整数比为___________ 。
(6)某种磁性氮化铁的结构如图所示,N 随机排列在 Fe 构成的正四面体空隙中。正六棱柱底边长为 a nm,高为 c nm,阿伏加德罗常数的值为 NA,则该磁性氮化铁的晶体密度为_____ g‧cm-3(列出计算式)。

(1)基态锰原子的价层电子排布图(轨道表示式)为
(2)与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3)鉴定 Ni2+的特征反应如下所示:

将丁二酮肟加入 Ni2+溶液中,生成一种鲜红色的二丁二酮肟合镍(Ⅱ)螯合物,在该螯合物中,碳原子的杂化方式是
(4)已知:r(Fe2+)为 61pm,r(Co2+)为 65pm。在隔绝空气条件下分别加热 FeCO3和 CoCO3,实验测得 FeCO3的分解温度低于 CoCO3,原因是
(5)Ni 可以形成多种氧化物,其中一种 NiaO 晶体晶胞结构为 NaCl 型,由于晶体缺陷,a 的值为 0. 88,且晶体中的 Ni 分别为 Ni2+、Ni3+,则晶体中 Ni2+与 Ni3+的最简整数比为
(6)某种磁性氮化铁的结构如图所示,N 随机排列在 Fe 构成的正四面体空隙中。正六棱柱底边长为 a nm,高为 c nm,阿伏加德罗常数的值为 NA,则该磁性氮化铁的晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)Cu2+基态核外电子排布式为_____________________ 。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型为__________ ,中心原子杂化类型为________________ 。
②X的沸点比水低的主要原因是___________________ 。
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为_________ ,其中基态S原子中,核外电子占据的最高能层的符号是_________ ,占据最高能级电子的电子云轮廓图为________ 形。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则SO2中的大π键应表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则SO2中的大π键应表示为______________ 。
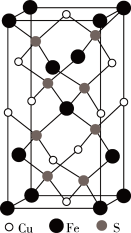
(4)四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为_______________ ,S2-的配位数为____________________ 。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加 德罗常数的值,CuFeS2晶体的密度是____________ g/cm3(列出计算式)。
(1)Cu2+基态核外电子排布式为
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型为
②X的沸点比水低的主要原因是
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则SO2中的大π键应表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则SO2中的大π键应表示为(4)四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加 德罗常数的值,CuFeS2晶体的密度是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
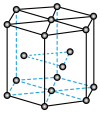
【推荐3】I.(1)Mg、Ni、Cu等金属可能形成金属互化物。金属互化物结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___ 测定。
(2)根据Cu、Zn的原子结构比较第一电离能:I1(Cu)___ I1(Zn)或(填“大于”、“等于”或“小于”)。
(3)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为____ 。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为____ g·cm-3(列出计算式)。
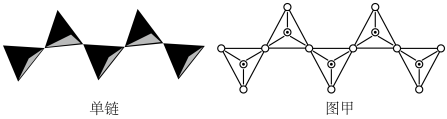
II.在硅酸盐中, 四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。

图甲为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为___ ,化学式为___ 。
(2)根据Cu、Zn的原子结构比较第一电离能:I1(Cu)
(3)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

II.在硅酸盐中,
 四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
图甲为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为

您最近一年使用:0次



