(1)仅由第二周期元素组成的共价分子中,互为等电子体的是:_______ 和_____ ;_____ 和______ 。
(2)HF的沸点比HCl的高,原因是____ ;SiH4的沸点比CH4的高,原因是________ 。
(3)在下列物质①P4 ②NH3 ③HCN ④BF3 ⑤H2O ⑥SO3 ⑦CH3Cl中,属于含有极性键的极性分子的是(填序号)_______ 。
(4)根据价层电子对互斥理论判断下列问题:
CO2分子中,中心原子的杂化方式为__ 杂化,分子的立体构型为________ 。
SO32-中,中心原子的杂化方式为__ 杂化,离子的立体构型为_________ 。
HCHO分子中,中心原子的杂化方式为__ 杂化,分子的立体构型为_________ 。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO4_____ HClO2 H2CO3______ H2SiO3 H2SO3_______ H2SO4
(2)HF的沸点比HCl的高,原因是
(3)在下列物质①P4 ②NH3 ③HCN ④BF3 ⑤H2O ⑥SO3 ⑦CH3Cl中,属于含有极性键的极性分子的是(填序号)
(4)根据价层电子对互斥理论判断下列问题:
CO2分子中,中心原子的杂化方式为
SO32-中,中心原子的杂化方式为
HCHO分子中,中心原子的杂化方式为
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO4
更新时间:2019-04-19 21:55:52
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】将氟气通入氢氧化钠溶液中,可得OF2。OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2的中文名称是_______ ,OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比, OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2的中文名称是
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比, OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在2022年冬奥会上滑冰运动场馆中使用了美丽的透光气囊材料,该材料由乙烯( )与四氟乙烯(
)与四氟乙烯( )的共聚物(
)的共聚物(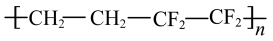 )制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:
)制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:
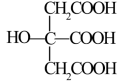
(1)三氟乙酸( )的酸性
)的酸性___________ (填“强”或“弱”)于乙酸,原因是___________ 。
(2)利用该技术将 制成冰的过程中发生改变的是___________(填字母)。
制成冰的过程中发生改变的是___________(填字母)。
(3)适当条件下, 可以转化为
可以转化为 :
: ,
, 的相对分子质量比
的相对分子质量比 的大,但
的大,但 的沸点比水的低,主要原因是
的沸点比水的低,主要原因是___________ ,下列有关 与
与 的说法正确的是
的说法正确的是___________ (填字母)。
A.均含有 键 B.键角:
键 B.键角: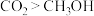 C.均是极性分子
C.均是极性分子
 )与四氟乙烯(
)与四氟乙烯( )的共聚物(
)的共聚物(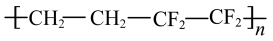 )制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:
)制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:(1)三氟乙酸(
 )的酸性
)的酸性(2)利用该技术将
 制成冰的过程中发生改变的是___________(填字母)。
制成冰的过程中发生改变的是___________(填字母)。| A.共价键数目 | B.范德华力大小 | C.氢键数目 | D.分子种类 |
 可以转化为
可以转化为 :
: ,
, 的相对分子质量比
的相对分子质量比 的大,但
的大,但 的沸点比水的低,主要原因是
的沸点比水的低,主要原因是 与
与 的说法正确的是
的说法正确的是A.均含有
 键 B.键角:
键 B.键角: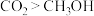 C.均是极性分子
C.均是极性分子
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】对氨基苯甲酸和邻氨基苯甲酸分别用于防晒剂和制造药物,某小组以甲苯为主要原料进行合成,设计流程如下图。
ii .苯胺中的氨基易被氧化
iii.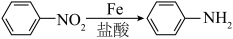
(1)基态N原子的电子有___________ 种运动状态。
(2)氨基苯甲酸中C=O中O原子的杂化方式是___________ 。
(3)组成氨基苯甲酸的4种元素的电负性由大到小的顺序是___________ 。
(4)对氨基苯甲酸和邻氨基苯甲酸的沸点分别是339.9℃和311.9℃,沸点不同的原因是___________ 。
(5)甲同学认为邻氨基苯甲酸可以形成“内盐”,请从化学键的角度解释“内盐”中离子键的形成过程___________ 。
(6)步骤A的反应条件___________ ;步骤C中生成1 mol对氨基苯甲酸电子转移___________ mol。
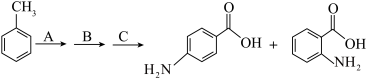
ii .苯胺中的氨基易被氧化
iii.
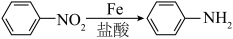
(1)基态N原子的电子有
(2)氨基苯甲酸中C=O中O原子的杂化方式是
(3)组成氨基苯甲酸的4种元素的电负性由大到小的顺序是
(4)对氨基苯甲酸和邻氨基苯甲酸的沸点分别是339.9℃和311.9℃,沸点不同的原因是
(5)甲同学认为邻氨基苯甲酸可以形成“内盐”,请从化学键的角度解释“内盐”中离子键的形成过程
(6)步骤A的反应条件
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】CaC2可用于固氮:CaC2+N2 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是______ 。
(3)NH3中N原子的杂化方式为______ ;根据价层电子对互斥理论推测CO 的空间构型为
的空间构型为______ 。
(4)CaCN2中阴离子为CN ,与CN
,与CN 互为等电子体的分子有
互为等电子体的分子有______ (填写一种化学式即可);写出CaCN2水解反应的化学方程式______ 。
 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
(2)C、N、O三种元素的第一电离能由小到大的顺序是
(3)NH3中N原子的杂化方式为
 的空间构型为
的空间构型为(4)CaCN2中阴离子为CN
 ,与CN
,与CN 互为等电子体的分子有
互为等电子体的分子有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】稀土元素是元素周期表中第IIIB族钪、钇和镧系元素的总称。第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高新技术产业。回答下列问题:
(1)基态Fe原子的价电子排布式为____ ;铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同,则晶格能NiO____ (填“>”“<”或“=”)FeO。
(2)氨硼烷化合物( )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为
)是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___ (填化学式);氨硼烷分子中N、B原子的杂化方式分别为___ 、___ 。
(3) 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
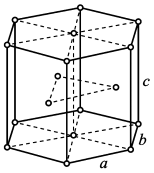
(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数: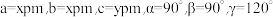 。每个晶胞含有
。每个晶胞含有___ 个钕原子,设阿伏加 德罗常数为 ,则金属钕的密度为
,则金属钕的密度为___  (Nd的相对原子质量为M,列出计算表达式)
(Nd的相对原子质量为M,列出计算表达式)
(1)基态Fe原子的价电子排布式为
(2)氨硼烷化合物(
 )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为
)是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为(3)
 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数:
 。每个晶胞含有
。每个晶胞含有 ,则金属钕的密度为
,则金属钕的密度为 (Nd的相对原子质量为M,列出计算表达式)
(Nd的相对原子质量为M,列出计算表达式)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】在H2O、NH3、CS2、CH4、BF3分子中:
(1)存在π键的共价化合物分子是_______ (填分子式,下同)。
(2)具有直线形结构的分子是_______ 。
(3)具有正四面体形结构的分子是_______ 。
(4)具有三角锥形结构的分子是_______ 。
(5)具有sp2杂化轨道类型的分子是_______ 。
(6)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ 。OF2分子的空间构型为_______ 。
(1)存在π键的共价化合物分子是
(2)具有直线形结构的分子是
(3)具有正四面体形结构的分子是
(4)具有三角锥形结构的分子是
(5)具有sp2杂化轨道类型的分子是
(6)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答一下回答以下关于第三周期元素及其化合物的问题。
(1)Na原子核外共有___ 种不同运动状态的电子,Al的原子结构示意图___ 。
(2)相同压强下,部分元素氟化物的熔点见表:
试解释上表中氟化物熔点差异的原因:___ 。
(3)SiF4分子的空间构型为____ ,SiF4中Si-F键间的键角是____ 。
(4)在P、S、Cl三种元素形成的氢化物中,热稳定性最大的是____ (填氢化物的化学式)。
(1)Na原子核外共有
(2)相同压强下,部分元素氟化物的熔点见表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因:
(3)SiF4分子的空间构型为
(4)在P、S、Cl三种元素形成的氢化物中,热稳定性最大的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P能级中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于___________ 分子(填“极性”或“非极性”)。
(2)当n=3时, A与B形成的晶体属于___________ 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中作为配位体之一的NH3分子的空间构型为___________ 。H2O分子中心原子的杂化方式为___________ 。
(5)金属铜晶体的堆积方式为___________ 。
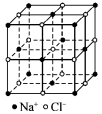
(6)如图是NaCl晶体的结构示意图,已知阿伏加德罗常数的值(Na),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,NaCl的相对分子质量为M,则NaCl晶体的密度为___________ g·cm-3。
(1)当n=2时,AB2属于
(2)当n=3时, A与B形成的晶体属于
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中作为配位体之一的NH3分子的空间构型为
(5)金属铜晶体的堆积方式为
(6)如图是NaCl晶体的结构示意图,已知阿伏加德罗常数的值(Na),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,NaCl的相对分子质量为M,则NaCl晶体的密度为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
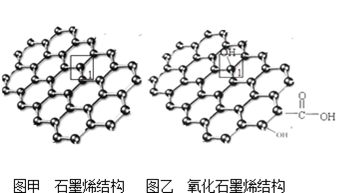
(1)图甲中,1号C与相邻C形成σ键的个数为___________ ;
(2)图乙中,1号C的杂化方式是___________ ,该C与相邻C形成的键角___________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角.
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有___________ (填元素符号)。

(1)图甲中,1号C与相邻C形成σ键的个数为
(2)图乙中,1号C的杂化方式是
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为_____ ;1mol C22-中含有的 键数目为
键数目为________ 。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为___ 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________ ;分子中处于同一直线上的原子数目最多为___________ 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_________ 。
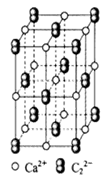
(1)CaC2中C22-的电子式可表示为
 键数目为
键数目为(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为_______ 。
(2)第一电离能As_______ Se(填“>”或“<”)。
(3) 是两性氧化物,
是两性氧化物, 溶于盐酸生成
溶于盐酸生成 ,
, 用
用 还原生成
还原生成 。
。
① 的中心原子的杂化方式为
的中心原子的杂化方式为_______ 。
② 分子中H-As-H键角
分子中H-As-H键角_______ 109.5°(填“>”、“=”或“<”)。
(4)有机砷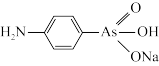 是治疗昏睡病的药物,它存在的化学键种类为
是治疗昏睡病的药物,它存在的化学键种类为_______ (填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
(1)基态Ni原子的价电子排布式为
(2)第一电离能As
(3)
 是两性氧化物,
是两性氧化物, 溶于盐酸生成
溶于盐酸生成 ,
, 用
用 还原生成
还原生成 。
。①
 的中心原子的杂化方式为
的中心原子的杂化方式为②
 分子中H-As-H键角
分子中H-As-H键角(4)有机砷
 是治疗昏睡病的药物,它存在的化学键种类为
是治疗昏睡病的药物,它存在的化学键种类为a.离子键 b.σ键 c.π键 d.碳碳双键
您最近一年使用:0次

 互为等电子体的一种分子为
互为等电子体的一种分子为