700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是
 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A.反应在t1 min内的平均速率为v(H2)= mol·L-1·min-1 mol·L-1·min-1 |
| B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol |
| C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变 |
| D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应 |
更新时间:2019-04-29 17:05:21
|
相似题推荐
多选题
|
较难
(0.4)
名校
【推荐1】80℃时,NO2(g)+SO2(g) SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
 SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol • L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol • L-1 | 0.10 | 0.10 | 0.20 |
| A.容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol • L-1• min-1 |
| B.达到平衡时,容器丙中正反应速率与容器甲相等 |
| C.温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 |
| D.容器乙中若起始时改充0.10 mol•L-1 NO2和0.20mol•L-1 SO2,达到平衡时c(NO)与原平衡相同 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】在石油化工中,酸碱催化占有重要地位,某酸碱催化反应(M和D制取N)的机理如下:






已知:基元反应的速率与反应物浓度幂之积成正比;该反应的决速步骤为基元反应中 和
和 的生成;总反应速率为决速反应的速率之和。下列说法错误的是
的生成;总反应速率为决速反应的速率之和。下列说法错误的是






已知:基元反应的速率与反应物浓度幂之积成正比;该反应的决速步骤为基元反应中
 和
和 的生成;总反应速率为决速反应的速率之和。下列说法错误的是
的生成;总反应速率为决速反应的速率之和。下列说法错误的是A.生成 的速率为 的速率为 | B.酸性增大,会使M转化为 ,降低总反应速率 ,降低总反应速率 |
C.总反应的速率常数 | D.当 时,总反应的速率常数 时,总反应的速率常数 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐1】T ℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是

 PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
| A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1 |
| B.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80% |
| C.T ℃时,该反应的化学平衡常数K=0.025 |
| D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v正>v逆 |
您最近一年使用:0次
【推荐2】一定温度下,向2L恒容容器中充入 A和
A和 B,发生反应
B,发生反应 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
 A和
A和 B,发生反应
B,发生反应 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是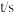 | 0 | 5 | 15 | 25 | 35 |
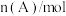 | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.前5s的平均反应速率 |
| B.由题目信息可知,正反应为放热反应 |
C.保持温度不变,起始时向容器中充入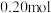 A、 A、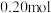 B和 B和 C,反应达平衡前 C,反应达平衡前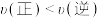 |
D.保持温度不变,起始时向容器中充入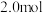 C,达平衡时,C的转化率等于80% C,达平衡时,C的转化率等于80% |
您最近一年使用:0次
多选题
|
较难
(0.4)
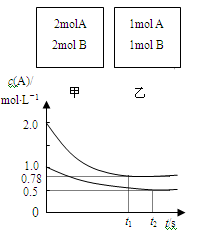
【推荐3】向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同温度下,发生反应:A(g)+B(g) xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示
下列说法正确的是
 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示
下列说法正确的是
| A.x不可能等于2 |
| B.甲、乙两容器中反应达平衡时,平衡常数K(甲) <K(乙) |
| C.将乙容器升温可使甲、乙容器内各物质的体积分数相同 |
| D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/L |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g) CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
 CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是| 容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
| Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
| Ⅲ | T2 | a | b | ||
| A.反应温度:T1<T2 |
| B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1 |
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则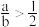 |
| D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。

下列说法正确的是
 CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。| 容器 | 温度 | CO | H2 | CH3OH |
| Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
| Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
| A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1 |
| B.a>1 |
| C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0 |
| D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐3】利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)⇌C3H6(g)+H2(g) ΔH。向起始体积为2L的恒压密闭容器中充入1mol丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
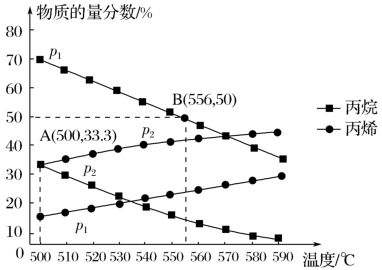
下列说法错误的是

下列说法错误的是
| A.反应的ΔH>0 |
| B.压强p2<0.1MPa |
C.556℃压强p1时,该反应的压强平衡常数为 |
| D.556℃压强p1时,容器中通入1.2molC3H8、0.8molC3H6、0.6molH2,此时v(正)>v(逆) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】已知反应:CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按w=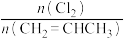 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w的关系,图乙表示正、逆反应的平衡常数与温度的关系,则下列说法错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w的关系,图乙表示正、逆反应的平衡常数与温度的关系,则下列说法错误的是

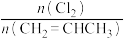 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w的关系,图乙表示正、逆反应的平衡常数与温度的关系,则下列说法错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w的关系,图乙表示正、逆反应的平衡常数与温度的关系,则下列说法错误的是
| A.图甲中,w2>1 |
| B.图乙中,A线表示正反应的平衡常数 |
| C.温度为T1、w=2时,Cl2的平衡转化率为50% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g) CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是
CO(g) +2H2(g)
 CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | bkJ | ckJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
| A.2c1>c3 | B.∣a∣+∣b∣=90.8 |
| C.2p2<p3 | D.a1+ a3<1 |
您最近一年使用:0次
【推荐3】某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如图所示。图a、b和c反应区温度维持恒定且相等,仅发生反应 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数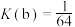 。
。
下列说法正确的是
 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数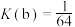 。
。
| 图a装置 | 图b装置 | 图c装置 | |
80s时反应区 的物质的量/mol 的物质的量/mol | 0.10 | 0.30 | x |
A.图a装置的化学平衡常数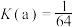 |
B.图a装置中,80s时 分解率为10% 分解率为10% |
| C.图c装置中,x一定大于0.3 |
D.图b装置中,前80s内 的平均渗透速率约为 的平均渗透速率约为 mol·s mol·s |
您最近一年使用:0次

 Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是
Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是


