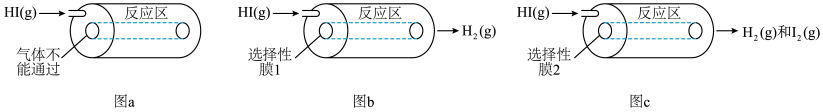
某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如图所示。图a、b和c反应区温度维持恒定且相等,仅发生反应 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数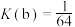 。
。
下列说法正确的是
 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数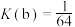 。
。
| 图a装置 | 图b装置 | 图c装置 | |
80s时反应区 的物质的量/mol 的物质的量/mol | 0.10 | 0.30 | x |
A.图a装置的化学平衡常数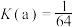 |
B.图a装置中,80s时 分解率为10% 分解率为10% |
| C.图c装置中,x一定大于0.3 |
D.图b装置中,前80s内 的平均渗透速率约为 的平均渗透速率约为 mol·s mol·s |
更新时间:2024-05-27 17:18:45
|
相似题推荐
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是( )
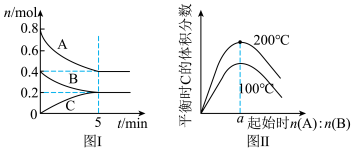

| A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·(L·min)-1 |
| B.图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的ΔH<0,且a=2 |
| C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】T℃时,向容积为2L的刚性容器中充入1 mol CO2和一定量的H2发生反应:CO2(g)+2H2(g)  HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始
HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入2molH2时,容器内气体的总压强为1.2p kPa。下列说法错误的是
的关系如图所示。已知:初始加入2molH2时,容器内气体的总压强为1.2p kPa。下列说法错误的是

 HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始
HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入2molH2时,容器内气体的总压强为1.2p kPa。下列说法错误的是
的关系如图所示。已知:初始加入2molH2时,容器内气体的总压强为1.2p kPa。下列说法错误的是
A.5 min时反应到达c点, (H2)=0.1 mol·L-1·min-1 (H2)=0.1 mol·L-1·min-1 |
B.随 增大, HCHO的平衡压强不断增大 增大, HCHO的平衡压强不断增大 |
C.b点时反应的平衡常数Kp =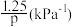 |
| D.c点时,再加入CO2(g)和H2O(g) ,使二者分压均增大0.2p kPa,平衡正向移动 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐3】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)反应过程中测得的部分数据见下表(表中最t2>t1):
下列说法正确的是
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A.反应在t1min内的平均速率为υ(H2)=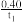 mol-1·L-1 ·min-1 mol-1·L-1 ·min-1 |
| B.保持其它条件不变,起始时向容器中充入0.60molCO和1.20molH2O,达到平衡时n(CO2)=0.40mol |
| C.保持其它条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 |
| D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】一种催化还原 的机理如图所示,下列说法正确的是
的机理如图所示,下列说法正确的是

 的机理如图所示,下列说法正确的是
的机理如图所示,下列说法正确的是
A. 中所含 中所含 的基态电子排布式为 的基态电子排布式为 |
B.中间体X和中间体Z中 的化合价相同 的化合价相同 |
| C.转化①中既有极性共价键的形成,也有非极性共价键的形成 |
D.总转化过程中每吸收1mol 需要消耗1mol 需要消耗1mol |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】聚醚多元醇(G)是合成聚氨酯(PU)、润滑油等的重要中间原料。以环氧丙烷( )为原料催化合成G的机理如下图所示:
)为原料催化合成G的机理如下图所示:

下列说法正确的是
 )为原料催化合成G的机理如下图所示:
)为原料催化合成G的机理如下图所示:
下列说法正确的是
| A.物质Ⅱ为催化剂 |
| B.物质Ⅲ中的配体有3种 |
| C.锌元素的化合价始终保持不变 |
| D.物质Ⅳ转化为物质Ⅴ属于氧化还原反应 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】将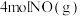 和
和 充入一个
充入一个 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应: ,测得
,测得 的平衡转化率随温度变化的曲线如图1所示;在催化剂、一定温度下对该反应进行研究,经过相同时间测
的平衡转化率随温度变化的曲线如图1所示;在催化剂、一定温度下对该反应进行研究,经过相同时间测 转化率与反应温度的关系曲线如图2所示。下列说法错误的是
转化率与反应温度的关系曲线如图2所示。下列说法错误的是

已知:反应速率 分别为正、逆反应速率常数。
分别为正、逆反应速率常数。
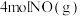 和
和 充入一个
充入一个 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应: ,测得
,测得 的平衡转化率随温度变化的曲线如图1所示;在催化剂、一定温度下对该反应进行研究,经过相同时间测
的平衡转化率随温度变化的曲线如图1所示;在催化剂、一定温度下对该反应进行研究,经过相同时间测 转化率与反应温度的关系曲线如图2所示。下列说法错误的是
转化率与反应温度的关系曲线如图2所示。下列说法错误的是
已知:反应速率
 分别为正、逆反应速率常数。
分别为正、逆反应速率常数。| A.图像中A点逆反应速率大于B点正反应速率 |
| B.C点转化率低于B点的原因可能是催化剂活性降低或平衡逆向移动造成的 |
C. 时反应的平衡常数 时反应的平衡常数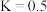 |
D. 的转化率为40%时, 的转化率为40%时,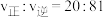 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐2】向体积均为1L的两恒容容器中分别充入2molX和1molY发生反应:
 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
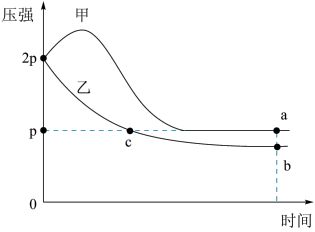

 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. | B.气体的总物质的量: |
| C.a点平衡常数:K>12 | D.反应速率: |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】一定温度下,向四个体积不等的恒容密闭容器中分别通入2molNOCl(g),发生反应2NOCl(g) 2NO(g)+Cl2(g)。tmin后,四个容器中NOCl的转化率如图所示。
2NO(g)+Cl2(g)。tmin后,四个容器中NOCl的转化率如图所示。
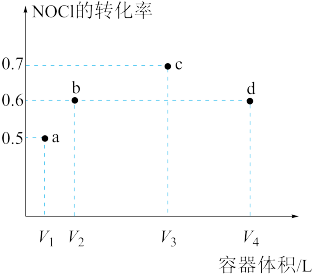
下列叙述一定正确的是
 2NO(g)+Cl2(g)。tmin后,四个容器中NOCl的转化率如图所示。
2NO(g)+Cl2(g)。tmin后,四个容器中NOCl的转化率如图所示。
下列叙述一定正确的是
| A.V1:V2=10:27 | B.b、d两点的压强相等 |
| C.c点对应容器中,v正=v逆 | D.t~(t+2)min内,a点的平均反应速率小于d点 |
您最近一年使用:0次
【推荐2】一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的A和B分别发生下列反应:3A(g)+B(g) 2C(g)+D(g)+E(s),下列说法正确的是
2C(g)+D(g)+E(s),下列说法正确的是
 2C(g)+D(g)+E(s),下列说法正确的是
2C(g)+D(g)+E(s),下列说法正确的是 | 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| A | B | A | B | ||
| 容器Ⅰ | 300 | 3 | 1 | 0.8 | |
| 容器Ⅱ | 300 | 6 | 2 | ||
| 容器Ⅲ | 240 | 3 | 1 | 0.4 | |
| A.该反应正反应为吸热反应 |
| B.反应达到平衡后加入2molE,A的转化率减小 |
| C.容器Ⅱ达到平衡时B的转化率比容器I大 |
| D.240℃ 时,该反应的平衡常数K=1.25 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐3】温度T1和T2时,分别将1 mol CH4和1.2 mol CO2充入体积为1L的密闭容器中,发生反应:CH4(g)+CO2(g)  2CO(g)+2H2(g),测得有关数据如下表:
2CO(g)+2H2(g),测得有关数据如下表:
下列说法正确的是
 2CO(g)+2H2(g),测得有关数据如下表:
2CO(g)+2H2(g),测得有关数据如下表:| 温度 | 时间/min | 0 | 5 | 10 | 15 | 20 |
| T1 | n(CH4)/mol | 1 | 0.75 | 0.60 | 0.50 | 0.50 |
| T2 | n(CH4)/mol | 1 | 0.65 | 0.45 | …… | 0.40 |
| A.该反应∆H<0 |
| B.T1时0~10min的平均反应速率v(CO)=0.04mol·L-1·min-1 |
| C.保持其他条件不变,T1时向平衡体系中再充入0.5 mol CH4和1 mol H2,重新达平衡前,v(正)<v(逆) |
| D.T 1时,若起始向容器中充入2 mol CH4和2.4 mol CO2,平衡时n(CH4)>1 mol |
您最近一年使用:0次

 ;②
;② ,反应①的速率可表示为
,反应①的速率可表示为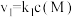 ,反应②的速率可表示为
,反应②的速率可表示为 (
( 、
、 为速率常数),图1为
为速率常数),图1为 温度时,该体系中M、X、Y、Z浓度随时间变化的曲线,图2为反应①和②的
温度时,该体系中M、X、Y、Z浓度随时间变化的曲线,图2为反应①和②的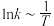 曲线,下列说法错误的是
曲线,下列说法错误的是
 表示Y浓度随时间变化的曲线
表示Y浓度随时间变化的曲线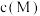 的减小,反应①②的速率均降低
的减小,反应①②的速率均降低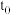 时刻体系中
时刻体系中 值变大
值变大 温度时活化能大小:反应①>反应②
温度时活化能大小:反应①>反应② ,
, 。在一定条件下存在
。在一定条件下存在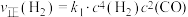 ,
, ,反应速率随温度的变化如图所示。下列说法错误的是
,反应速率随温度的变化如图所示。下列说法错误的是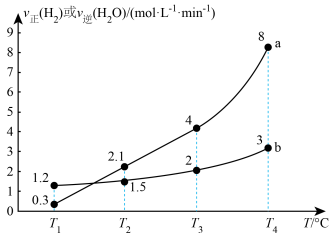
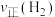

 和
和 时反应均达到平衡状态
时反应均达到平衡状态


