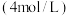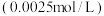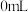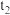研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____ 。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
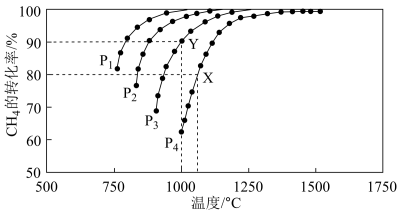
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________ 。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____ ,该温度下,反应的平衡常数为_________ (保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________ 。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________ (填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________ 。
(1)已知CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)
 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)
 CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向
更新时间:2019-05-08 18:13:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】用相同质量的锌片和铜粉跟相同浓度的足量的稀盐酸反应,得到的实验数据如表所示:
(1)实验①和②表明___ ,化学反应速率越大。表明固体表面积对反应速率有影响的实验编号是___ 和____ 。
(2)该实验的目的是探究____ 、___ 等因素对锌跟稀盐酸反应速率的影响。请设计一个实验方案证明盐酸的浓度对该反应速率的影响。____ 。
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
(2)该实验的目的是探究
您最近一年使用:0次
【推荐2】合成氨的反应对人类解决粮食问题贡献巨大,反应为N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)德国化学家F•Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如图,用 、
、 、
、 分别表示N2、H2、NH3。
分别表示N2、H2、NH3。
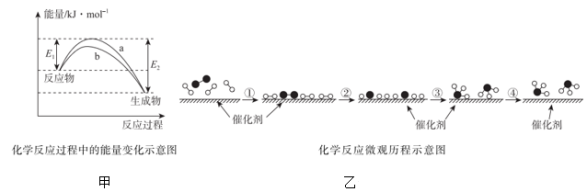
①该反应是___ (填“吸热”或“放热”)反应,其原因是反应物化学键断裂吸收的总能量___ (填“大于”或“小于”)生成物化学键形成放出的总能量。
②关于N2和H2在催化剂表面合成氨气的过程,下列说法正确的是___ (填序号)。
A.图甲中曲线a表示有催化剂时的能量变化情况
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在图乙②过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂可以使生成的氨气的量增多
(2)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。
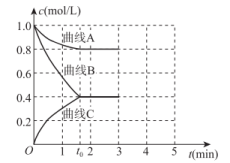
①表示c(N2)变化的曲线是___ (填“A”“B”或“C”)。
②0~t0时用H2表示的化学反应速率:v(H2)=___ mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是___ (填序号,可多选)。
a.容器中的压强不随时间变化
b.2c(H2)=3c(NH3)
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键
(3)人们曾认为N2+3H2 2NH3化学反应速率小,原材料利用率低,不可能用于工业化催化剂生产。化学家们不断地研究和改进该反应的条件,如催化剂、温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。下列反应条件的改变对反应速率的影响正确的是
2NH3化学反应速率小,原材料利用率低,不可能用于工业化催化剂生产。化学家们不断地研究和改进该反应的条件,如催化剂、温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。下列反应条件的改变对反应速率的影响正确的是___ (填序号)。
A.增大N2的浓度能加快反应速率
B.充入稀有气体增大压强能加快反应速率
C.升高温度能减慢反应速率
D.使用催化剂对反应速率无影响
 2NH3(g)。
2NH3(g)。(1)德国化学家F•Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如图,用
 、
、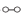 、
、 分别表示N2、H2、NH3。
分别表示N2、H2、NH3。
①该反应是
②关于N2和H2在催化剂表面合成氨气的过程,下列说法正确的是
A.图甲中曲线a表示有催化剂时的能量变化情况
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在图乙②过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂可以使生成的氨气的量增多
(2)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。

①表示c(N2)变化的曲线是
②0~t0时用H2表示的化学反应速率:v(H2)=
③下列能说明该反应达到平衡状态的是
a.容器中的压强不随时间变化
b.2c(H2)=3c(NH3)
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键
(3)人们曾认为N2+3H2
 2NH3化学反应速率小,原材料利用率低,不可能用于工业化催化剂生产。化学家们不断地研究和改进该反应的条件,如催化剂、温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。下列反应条件的改变对反应速率的影响正确的是
2NH3化学反应速率小,原材料利用率低,不可能用于工业化催化剂生产。化学家们不断地研究和改进该反应的条件,如催化剂、温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。下列反应条件的改变对反应速率的影响正确的是A.增大N2的浓度能加快反应速率
B.充入稀有气体增大压强能加快反应速率
C.升高温度能减慢反应速率
D.使用催化剂对反应速率无影响
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某同学设计实验探究丙酮碘化反应中,丙酮、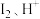 浓度对化学反应速率的影响。
浓度对化学反应速率的影响。
已知:
(1)研究丙酮浓度对反应速率的影响,应选择的实验为________ .
(2)实验④中,
________  ,加
,加 蒸馏水的目的是
蒸馏水的目的是________ .
(3)计算实验③中,以 表示的反应速率为
表示的反应速率为________  (列出表达式)
(列出表达式)
(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和 的浓度有关,而与
的浓度有关,而与 的浓度无关,查阅资料发现丙酮碘化反应的历程为:
的浓度无关,查阅资料发现丙酮碘化反应的历程为:

请依据反应历程,解释丙酮碘化反应速率与 浓度无关的原因
浓度无关的原因________________ .
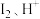 浓度对化学反应速率的影响。
浓度对化学反应速率的影响。已知:

编号 | 丙酮溶液 |
| 盐酸 | 蒸馏水 | 溶液褪色时间 |
① |
|
|
|
|
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
|
|
(1)研究丙酮浓度对反应速率的影响,应选择的实验为
(2)实验④中,

 ,加
,加 蒸馏水的目的是
蒸馏水的目的是(3)计算实验③中,以
 表示的反应速率为
表示的反应速率为 (列出表达式)
(列出表达式)(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和
 的浓度有关,而与
的浓度有关,而与 的浓度无关,查阅资料发现丙酮碘化反应的历程为:
的浓度无关,查阅资料发现丙酮碘化反应的历程为:
请依据反应历程,解释丙酮碘化反应速率与
 浓度无关的原因
浓度无关的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】天然气是一种重要的化工原料,现代工业中常用天然气生产氢气、一氧化碳、甲醇等高附加值化学品,或是将其用于燃料电池。
(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.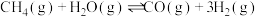
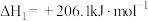
Ⅱ.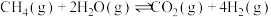
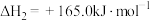
Ⅲ.
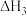
①反应Ⅱ在___________ (填“高温”、“低温”或“任何温度”)下为自发反应,反应Ⅲ的反应热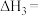
___________ 。
②已知反应I的正、逆反应活化能分别为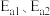 ,反应Ⅱ的正、逆反应活化能分别为
,反应Ⅱ的正、逆反应活化能分别为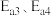 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③在一定条件下,向恒容密闭容器中通入1mol 和2mol
和2mol ,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是
,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是___________ (填序号)。
A.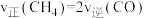
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D. 与
与 的物质的量之比不再改变
的物质的量之比不再改变
④一定条件下,向体积为VL的恒容密闭容器中通入1mol 和1mol
和1mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中 和
和 的物质的量均为0.2mol,此时CO的浓度为
的物质的量均为0.2mol,此时CO的浓度为___________  ,反应Ⅲ的平衡常数为
,反应Ⅲ的平衡常数为___________ 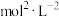 。
。
(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入 ,
, 时刻,已消耗的
时刻,已消耗的 体积为67.2L(标准状况下),继续通入
体积为67.2L(标准状况下),继续通入 ,此时负极的电极反应式为
,此时负极的电极反应式为___________ ;若向 时刻的溶液中加入
时刻的溶液中加入___________ molKOH并将溶液混匀,可使溶液中只含有一种溶质。

(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.
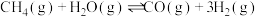
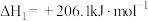
Ⅱ.
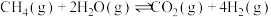
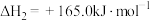
Ⅲ.

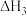
①反应Ⅱ在
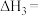
②已知反应I的正、逆反应活化能分别为
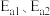 ,反应Ⅱ的正、逆反应活化能分别为
,反应Ⅱ的正、逆反应活化能分别为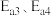 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③在一定条件下,向恒容密闭容器中通入1mol
 和2mol
和2mol ,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是
,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是A.
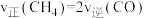
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D.
 与
与 的物质的量之比不再改变
的物质的量之比不再改变④一定条件下,向体积为VL的恒容密闭容器中通入1mol
 和1mol
和1mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中 和
和 的物质的量均为0.2mol,此时CO的浓度为
的物质的量均为0.2mol,此时CO的浓度为 ,反应Ⅲ的平衡常数为
,反应Ⅲ的平衡常数为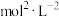 。
。(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入
 ,
, 时刻,已消耗的
时刻,已消耗的 体积为67.2L(标准状况下),继续通入
体积为67.2L(标准状况下),继续通入 ,此时负极的电极反应式为
,此时负极的电极反应式为 时刻的溶液中加入
时刻的溶液中加入
您最近一年使用:0次
【推荐2】CO2的综合利用有利于碳达峰、“碳中和”目标的最终实现。催化CO2和H2能够制取甲醇。
Ⅰ.在催化剂作用下,CO2、H2同时发生如下反应:
反应1(主反应):CO2(g) +3H2(g)=CH3OH(l) +H2O(g) △H= -86.9 kJ·mol-1
反应2(副反应):CO2(g) +H2(g)=CO(g) +H2O(g) △H= +41.2 kJ·mol-1
(1)反应2的发生不利于反应1中CH3OH(l)生成的原因是_______ ;一定温度、压强下,为了提高反应速率和CH3OH(1)的选择性,应当_______ 。
(2)假设某温度下,反应1的速率大于反应2的速率,则下列反应过程中的能量变化示意图正确的是_______(填字母)。
(3)若在绝热恒容的密闭体系中进行上述反应,下列能说明反应1达到平衡状态的是_______ ( 填序号)。
①v(CO2)正和v(H2)逆的比值为1:2
②CO2和H2O的物质的量相等
③H2的百分含量不变
④容器的温度恒定不变
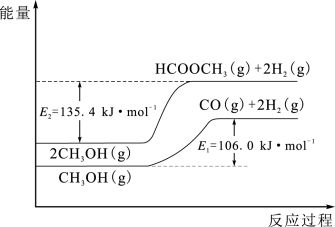
Ⅱ.工业上常用甲醇脱氢制重要的化工产品“万能中间体-----HCOOCH3”,具有工艺流程短、原料单一、反应条件温和等优点。该工艺过程涉及如下反应:
反应Ⅰ :2CH3OH(g) HCOOCH3(g) +2H2(g) △H1
HCOOCH3(g) +2H2(g) △H1
反应Ⅱ:HCOOCH3(g) 2CO(g) +2H2(g) △H2
2CO(g) +2H2(g) △H2
反应Ⅲ:CH3OH(g) CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
(4)反应Ⅰ、Ⅲ的能量变化如图所示,则△H2 =_______ kJ·mol-1
(5)一定温度下,向体积为V L的恒容密闭容器中通入1 mol CH3OH(g)发生上述反应,t min达到平衡时,容器中HCOOCH3为a mol ,CO为b mol ,0~t min内v(CH30H) =_______ mol·L-1·min-1(用含a、b、V、t的代数式表示),该温度下,反应Ⅲ的平衡常数K=_______ (用含a、b、V的代数式表示)。
Ⅰ.在催化剂作用下,CO2、H2同时发生如下反应:
反应1(主反应):CO2(g) +3H2(g)=CH3OH(l) +H2O(g) △H= -86.9 kJ·mol-1
反应2(副反应):CO2(g) +H2(g)=CO(g) +H2O(g) △H= +41.2 kJ·mol-1
(1)反应2的发生不利于反应1中CH3OH(l)生成的原因是
(2)假设某温度下,反应1的速率大于反应2的速率,则下列反应过程中的能量变化示意图正确的是_______(填字母)。
A. | B. | C.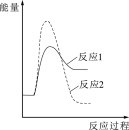 | D.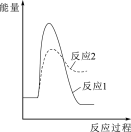 |
①v(CO2)正和v(H2)逆的比值为1:2
②CO2和H2O的物质的量相等
③H2的百分含量不变
④容器的温度恒定不变
Ⅱ.工业上常用甲醇脱氢制重要的化工产品“万能中间体-----HCOOCH3”,具有工艺流程短、原料单一、反应条件温和等优点。该工艺过程涉及如下反应:
反应Ⅰ :2CH3OH(g)
 HCOOCH3(g) +2H2(g) △H1
HCOOCH3(g) +2H2(g) △H1反应Ⅱ:HCOOCH3(g)
 2CO(g) +2H2(g) △H2
2CO(g) +2H2(g) △H2反应Ⅲ:CH3OH(g)
 CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3(4)反应Ⅰ、Ⅲ的能量变化如图所示,则△H2 =

(5)一定温度下,向体积为V L的恒容密闭容器中通入1 mol CH3OH(g)发生上述反应,t min达到平衡时,容器中HCOOCH3为a mol ,CO为b mol ,0~t min内v(CH30H) =
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】已知可逆反应:Fe(s) + CO2(g)  FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
(1)写出该反应的平衡常数表达式____________________ 。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________ ;
②充入氦气,混合气体的密度__________ 。
(3)该反应的逆反应速率随时间变化情况如右图所示。
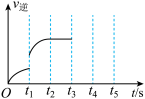
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______ (选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~ t5时间段的v逆变化曲线______ 。
③能作为判断该反应达到平衡状态的依据是______ (选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
 FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(1)写出该反应的平衡常数表达式
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量
②充入氦气,混合气体的密度
(3)该反应的逆反应速率随时间变化情况如右图所示。

①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~ t5时间段的v逆变化曲线
③能作为判断该反应达到平衡状态的依据是
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.二甲醚是一种重要的清洁燃料,可替代氟氯代烷作制冷剂,利用水煤气合成二甲醚的三步反应如下:

请回答下列问题:
(1)由 和
和 直接制备二甲醚的总反应:
直接制备二甲醚的总反应: 的
的
_______  。
。
(2)某温度下反应 的平衡常数为400,此温度下,在密闭容器中加入
的平衡常数为400,此温度下,在密闭容器中加入 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正_______ v逆(填“>”“<”或“=”)。
②若加入 后,经10min反应达到平衡,此时
后,经10min反应达到平衡,此时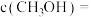
_______  ,该时间段内
,该时间段内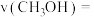
_______  。
。
Ⅱ.汽车尾气中含有 、
、 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:已知
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:已知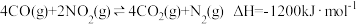 。
。
(3)对于该反应,改变某一反应条件(温度: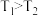 ),下列图象正确的是_______(填序号)。
),下列图象正确的是_______(填序号)。
(4)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,甲: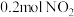 ,
,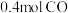 ;乙:
;乙: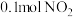 ,
,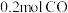 。经过一段时间后达到平衡状态。
。经过一段时间后达到平衡状态。
① 的平衡体积分数:甲
的平衡体积分数:甲_______ 乙(填“>”“=”“<”或“不确定”,下同)。
② 的平衡浓度:甲
的平衡浓度:甲_______ 乙。


请回答下列问题:
(1)由
 和
和 直接制备二甲醚的总反应:
直接制备二甲醚的总反应: 的
的
 。
。(2)某温度下反应
 的平衡常数为400,此温度下,在密闭容器中加入
的平衡常数为400,此温度下,在密闭容器中加入 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:| 物质 |  |  |  |
浓度/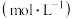 | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正
②若加入
 后,经10min反应达到平衡,此时
后,经10min反应达到平衡,此时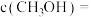
 ,该时间段内
,该时间段内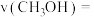
 。
。Ⅱ.汽车尾气中含有
 、
、 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:已知
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:已知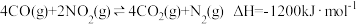 。
。(3)对于该反应,改变某一反应条件(温度:
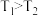 ),下列图象正确的是_______(填序号)。
),下列图象正确的是_______(填序号)。A.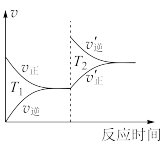 | B.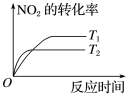 | C.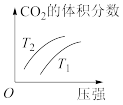 | D. |
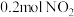 ,
,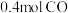 ;乙:
;乙: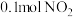 ,
,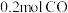 。经过一段时间后达到平衡状态。
。经过一段时间后达到平衡状态。①
 的平衡体积分数:甲
的平衡体积分数:甲②
 的平衡浓度:甲
的平衡浓度:甲
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
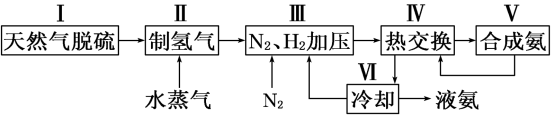
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________ 。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________ 。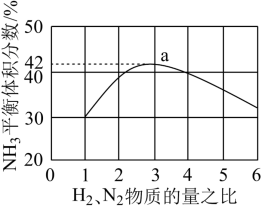
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________ 。
 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为

(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】汽车尾气中通常含有NxOy和CO等大气污染物,科学家利用高效催化剂实现了汽车尾气的转化,进而减少了汽车尾气对大气的污染。
(1)已知:①CO的燃烧热∆H1=-283 kJ·mol-1;
②N2(g)+O2(g)=2NO(g) ∆H2=+183 kJ·mol-1。
则NO和CO反应的热化学方程式为_______ 。
(2)一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:4CO(g)+2NO2(g)⇌N2(g)+4CO2(g) ∆H<0,测得相关数据如下:
①5~10min内,用N2的浓度变化表示的反应速率为_______ 。
②下列表述能说明该反应已达到平衡状态的是_______ (填字母)。
A.气体颜色不再变化 B.气体密度不再变化 C.气体的平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中通入1.0 mol NO2和1.0 mol CO,在t1时刻反应再次达到平衡,则NO2的转化率相比原平衡会_ (填“增大“减小”或“不变”)。
④该温度下,反应的化学平衡常数K=_______ (保留两位有效数字)。
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极)。
①写出该电池负极上发生的电极反应:_______ 。
②常温下,用该燃料电池(惰性电极)电解2 L饱和食盐水(足量),当两极共生成4.48 L(已折算为标准状况)气体时,电解池溶液的pH=_ 。(忽略溶液的体积变化)
(1)已知:①CO的燃烧热∆H1=-283 kJ·mol-1;
②N2(g)+O2(g)=2NO(g) ∆H2=+183 kJ·mol-1。
则NO和CO反应的热化学方程式为
(2)一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:4CO(g)+2NO2(g)⇌N2(g)+4CO2(g) ∆H<0,测得相关数据如下:
| t/min | 0 | 5 | 10 | 15 | 20 |
| c(NO 2)/mol∙L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol∙L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5~10min内,用N2的浓度变化表示的反应速率为
②下列表述能说明该反应已达到平衡状态的是
A.气体颜色不再变化 B.气体密度不再变化 C.气体的平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中通入1.0 mol NO2和1.0 mol CO,在t1时刻反应再次达到平衡,则NO2的转化率相比原平衡会
④该温度下,反应的化学平衡常数K=
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极)。
①写出该电池负极上发生的电极反应:
②常温下,用该燃料电池(惰性电极)电解2 L饱和食盐水(足量),当两极共生成4.48 L(已折算为标准状况)气体时,电解池溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】“绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知: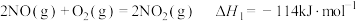
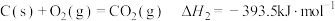
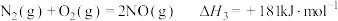
若某反应的平衡常数表达式为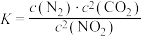 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_______ 。
(2) 时,存在如下平衡:
时,存在如下平衡: 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的浓度关系为:
的浓度关系为: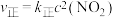 ,
,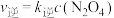 (
( 、
、 是速率常数),且
是速率常数),且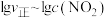 与
与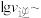
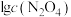 的关系如图所示。
的关系如图所示。
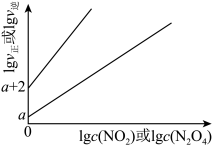
① 时,该反应的平衡常数
时,该反应的平衡常数
_______ 。
② 时,往刚性容器中充入一定量
时,往刚性容器中充入一定量 ,平衡后测得
,平衡后测得 为
为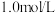 ,则平衡时
,则平衡时 的物质的量分数为
的物质的量分数为_______ (以分数表示)。
(3)用活性炭还原法处理氮氧化物的有关反应为: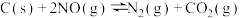 。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在
。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在 时刻改变某一条件,其反应过程如图所示。
时刻改变某一条件,其反应过程如图所示。
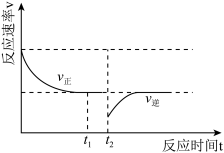
①则 时刻改变的条件为
时刻改变的条件为_______ 。
② 时刻的
时刻的
_______  时刻的
时刻的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)在恒容密闭容器中发生反应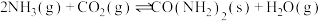
 。下列说法正确的是_______。
。下列说法正确的是_______。
(1)已知:
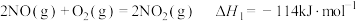
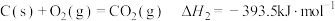
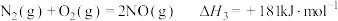
若某反应的平衡常数表达式为
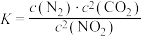 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)
 时,存在如下平衡:
时,存在如下平衡: 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的浓度关系为:
的浓度关系为: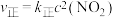 ,
,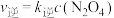 (
( 、
、 是速率常数),且
是速率常数),且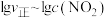 与
与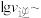
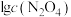 的关系如图所示。
的关系如图所示。
①
 时,该反应的平衡常数
时,该反应的平衡常数
②
 时,往刚性容器中充入一定量
时,往刚性容器中充入一定量 ,平衡后测得
,平衡后测得 为
为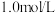 ,则平衡时
,则平衡时 的物质的量分数为
的物质的量分数为(3)用活性炭还原法处理氮氧化物的有关反应为:
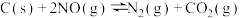 。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在
。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在 时刻改变某一条件,其反应过程如图所示。
时刻改变某一条件,其反应过程如图所示。
①则
 时刻改变的条件为
时刻改变的条件为②
 时刻的
时刻的
 时刻的
时刻的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)在恒容密闭容器中发生反应
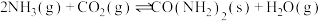
 。下列说法正确的是_______。
。下列说法正确的是_______。A.及时分离出生成的尿素,有利于 的转化率增大 的转化率增大 |
| B.反应达到平衡后,混合气体的密度不再发生改变 |
| C.反应在任何温度下都能自发进行 |
| D.当尿素的质量不变时,说明反应达到平衡 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO  2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H________ 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________________ 。
(3)假设在密闭容器中发生上述反应,投入相等的反应物,反应刚开始时下列措施能提高NO反应速率的是_______ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,催化剂比表面积会影响化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在下表中填入剩余的实验条件数据。
通过这3组实验,可以得出的温度、催化剂比表面积对化学反应速率的影响规律是___________________________________________________________ .
 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H
(2)前2s内的平均反应速率v(N2)=
(3)假设在密闭容器中发生上述反应,投入相等的反应物,反应刚开始时下列措施能提高NO反应速率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,催化剂比表面积会影响化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在下表中填入剩余的实验条件数据。
| 实验 编号 | T/℃ | NO初始浓度 mol·L-1 | CO初始浓度 mol·L-1 | 催化剂的比表面积 m2·g-1 | 达到平衡的时间 分钟 |
| Ⅰ | 280 | l.20×10-3 | 5.80×10-3 | 82 | 200 |
| Ⅱ | l.20×10-3 | 124 | 120 | ||
| Ⅲ | 350 | 5.80×10-3 | 124 | 5 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】2021年我国制氢量位居世界第一,工业制氢有多种途径。
(1)利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在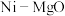 催化下制取氢气发生如下反应
催化下制取氢气发生如下反应
反应Ⅰ: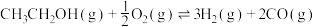

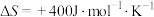
若该反应能够自发进行,对温度T的要求为_____ (温度以K作单位)。
(2)利用水煤气转化法制氢涉及的反应如下
反应Ⅱ: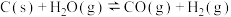
反应Ⅲ:
①下列说法正确的是_____ (填序号)。
A.增大 的用量,反应Ⅱ生成
的用量,反应Ⅱ生成 的速率加快
的速率加快
B.混合气体的密度保持不变时,说明反应Ⅲ已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②在一定温度下,向体积为 的密闭容器中加入足量的
的密闭容器中加入足量的 和
和
 ,起始压强为
,起始压强为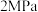 ,发生反应Ⅱ和Ⅲ,
,发生反应Ⅱ和Ⅲ, 后到达平衡,此时
后到达平衡,此时 的转化率为70%,
的转化率为70%, 的物质的量为
的物质的量为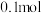 。则反应
。则反应 内用
内用 分压的变化量表示的反应速率
分压的变化量表示的反应速率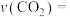
_____ 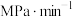 (气体分压
(气体分压 总压
总压 气体的物质的量分数),此温度下反应Ⅱ用平衡分压代替平衡浓度表示的化学平衡常数
气体的物质的量分数),此温度下反应Ⅱ用平衡分压代替平衡浓度表示的化学平衡常数
_____ (计算结果保留两位小数)。
③反应Ⅲ在不同催化剂作用下(反应相同时间),温度与CO转化率的关系如图所示。

催化剂应选择_____ ;随着温度的升高,单位时间内 的转化率是先升后降,“后降”的可能原因是
的转化率是先升后降,“后降”的可能原因是_____ 。
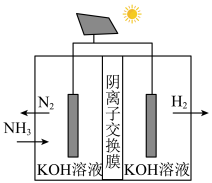
(3)氨电解法制氢气取得了重要技术突破,其装置如图所示,则阳极的电极反应式为_____ 。
(1)利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在
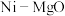 催化下制取氢气发生如下反应
催化下制取氢气发生如下反应反应Ⅰ:
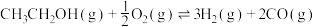

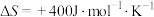
若该反应能够自发进行,对温度T的要求为
(2)利用水煤气转化法制氢涉及的反应如下
反应Ⅱ:
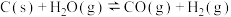
反应Ⅲ:

①下列说法正确的是
A.增大
 的用量,反应Ⅱ生成
的用量,反应Ⅱ生成 的速率加快
的速率加快B.混合气体的密度保持不变时,说明反应Ⅲ已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②在一定温度下,向体积为
 的密闭容器中加入足量的
的密闭容器中加入足量的 和
和
 ,起始压强为
,起始压强为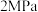 ,发生反应Ⅱ和Ⅲ,
,发生反应Ⅱ和Ⅲ, 后到达平衡,此时
后到达平衡,此时 的转化率为70%,
的转化率为70%, 的物质的量为
的物质的量为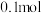 。则反应
。则反应 内用
内用 分压的变化量表示的反应速率
分压的变化量表示的反应速率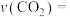
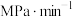 (气体分压
(气体分压 总压
总压 气体的物质的量分数),此温度下反应Ⅱ用平衡分压代替平衡浓度表示的化学平衡常数
气体的物质的量分数),此温度下反应Ⅱ用平衡分压代替平衡浓度表示的化学平衡常数
③反应Ⅲ在不同催化剂作用下(反应相同时间),温度与CO转化率的关系如图所示。

催化剂应选择
 的转化率是先升后降,“后降”的可能原因是
的转化率是先升后降,“后降”的可能原因是(3)氨电解法制氢气取得了重要技术突破,其装置如图所示,则阳极的电极反应式为

您最近一年使用:0次