(Ⅰ)已知在448 ℃时,反应H2(g)+I2(g)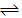 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)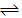 H2(g)+I2(g)的平衡常数K2为
H2(g)+I2(g)的平衡常数K2为________ ;反应1/2H2(g)+1/2I2(g)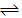 HI(g)的平衡常数K3为
HI(g)的平衡常数K3为______________________________________ 。
(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)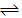 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________ 。
(2)该反应为________ (填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________ 。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________ (填“正向”或“逆向”)进行。
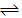 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)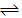 H2(g)+I2(g)的平衡常数K2为
H2(g)+I2(g)的平衡常数K2为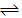 HI(g)的平衡常数K3为
HI(g)的平衡常数K3为(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)
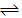 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将
2019高二·全国·专题练习 查看更多[4]
湖北省汉川市第二中学2020-2021学年高二上学期期中考试化学试题陕西省咸阳百灵中学2019-2020学年高二上学期期中考试化学(理)试题(已下线)2019年9月22日 《每日一题》选修4—— 每周一测步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡
更新时间:2019-05-21 08:07:17
|
相似题推荐
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】体积为2L的密闭容器中反应2NO2(g) 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃;NO、O2的起始浓度都为0,NO2的浓度随时间的变化如下图所示。请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃;NO、O2的起始浓度都为0,NO2的浓度随时间的变化如下图所示。请回答下列问题:

(1)下列叙述中不能作为2NO2(g) 2NO(g)+O2(g) 达到平衡状态的标志的是
2NO(g)+O2(g) 达到平衡状态的标志的是___________
A.v正(NO2)=2v逆(O2) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.NO的体积分数保持不变
(2)对比试验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是_____ (填字母)。
A.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验Ⅰ条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比试验Ⅰ和Ⅲ可知,该反应是吸热反应
(3)如图是在T1℃时密闭容器甲中NO的体积分数V%随时间t的变化曲线,请在图中补画出该反应在T2℃(T2>T1)时的NO体积分数随时间t的变化曲线_______ 。

(4)若实验Ⅰ中NO2的起始浓度改为1.2mol.L-1,其它条件不变,则达到平衡时所需要的时间______ 40min(填“大于”、“小于”或“不变”)
(5)若将实验Ⅲ所得的平衡混合气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气_____ L(设空气中N2与O2的体积比4:1,其它成分忽略不计)
 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃;NO、O2的起始浓度都为0,NO2的浓度随时间的变化如下图所示。请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃;NO、O2的起始浓度都为0,NO2的浓度随时间的变化如下图所示。请回答下列问题:
(1)下列叙述中不能作为2NO2(g)
 2NO(g)+O2(g) 达到平衡状态的标志的是
2NO(g)+O2(g) 达到平衡状态的标志的是A.v正(NO2)=2v逆(O2) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.NO的体积分数保持不变
(2)对比试验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是
A.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验Ⅰ条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比试验Ⅰ和Ⅲ可知,该反应是吸热反应
(3)如图是在T1℃时密闭容器甲中NO的体积分数V%随时间t的变化曲线,请在图中补画出该反应在T2℃(T2>T1)时的NO体积分数随时间t的变化曲线

(4)若实验Ⅰ中NO2的起始浓度改为1.2mol.L-1,其它条件不变,则达到平衡时所需要的时间
(5)若将实验Ⅲ所得的平衡混合气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】一定条件下,用 CO2和 H2反应生产燃料甲醇的热化学方程式为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,图1表示该反应过程中能量(单位为kJ·mol-1)的变化。回答下列问题:
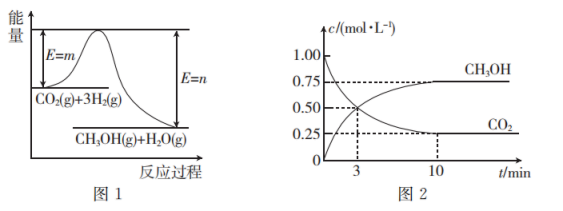
(1)该反应的 △H______ 0(填“>”或“<”),原因是______ 。
(2)在恒温恒容密闭容器中,下列能说明该反应已经达到平衡状态的是______ (填标号)。
A.v( H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)= v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1L的恒温(温度为 T℃)恒容密闭容器中,充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化如图 2 所示。从反应开始到平衡,用氢气的浓度变化表示的平均反应速率v(H2)=______ 平衡时容器内气体压强与起始时容器内气体压强之比为______ ,T℃时该反应的平衡常数K=______ L²·mol-2(保留 2 位小数)。

(1)该反应的 △H
(2)在恒温恒容密闭容器中,下列能说明该反应已经达到平衡状态的是
A.v( H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)= v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1L的恒温(温度为 T℃)恒容密闭容器中,充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化如图 2 所示。从反应开始到平衡,用氢气的浓度变化表示的平均反应速率v(H2)=
您最近一年使用:0次
【推荐3】在一定条件下,向容积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H=+49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
CO2(g)+3H2(g) △H=+49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
(1)该条件下反应的化学平衡常数表达式为K=___________ 。
(2)平衡时升高温度,化学平衡常数的变化为___________ (填“变大”、“变小”或“不变”)。
(3)该条件下反应到达平衡时,CH3OH的转化率为___________ ,混合气体的压强是反应前的___________ 倍。
(4)该条件下判断该反应达平衡状态的依据是(填序号)___________ 。
a.v正(CH3OH)=v逆(CO2) b.混合气体的密度不变
c.c(CH3OH)=c(H2O) d.混合气体的总物质的量不变
(5)将体积压缩为原来的一半,下列描述正确的是( )
a.正反应速率减小,逆反应速率增大 b.正反应速率增大,逆反应速率增大
c.正反应速率小于逆反应速率 d.c(CO2)减小
 CO2(g)+3H2(g) △H=+49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
CO2(g)+3H2(g) △H=+49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则(1)该条件下反应的化学平衡常数表达式为K=
(2)平衡时升高温度,化学平衡常数的变化为
(3)该条件下反应到达平衡时,CH3OH的转化率为
(4)该条件下判断该反应达平衡状态的依据是(填序号)
a.v正(CH3OH)=v逆(CO2) b.混合气体的密度不变
c.c(CH3OH)=c(H2O) d.混合气体的总物质的量不变
(5)将体积压缩为原来的一半,下列描述正确的是
a.正反应速率减小,逆反应速率增大 b.正反应速率增大,逆反应速率增大
c.正反应速率小于逆反应速率 d.c(CO2)减小
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______ .
已知:K1000℃>K800℃,则该反应是_________ 反应。(填“吸热”或“放热”);
(2)已知在800 ℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2 =
CO2(g)+H2(g)的平衡常数K2 = ______________ ,反应 CO2(g)+
CO2(g)+ H2(g)
H2(g)
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3 =
H2O(g)的平衡常数K3 =_______________ 。
(3)能判断该反应是否达到化学平衡状态的依据是_____________ 。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为_____________ ℃。
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
已知:K1000℃>K800℃,则该反应是
(2)已知在800 ℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g)
 CO2(g)+H2(g)的平衡常数K2 =
CO2(g)+H2(g)的平衡常数K2 =  CO2(g)+
CO2(g)+ H2(g)
H2(g)
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3 =
H2O(g)的平衡常数K3 =(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化加氢制备。已知:
Ⅰ、C2H2(g)+HCl(g) C2H3Cl(g),△H1=-124.8kJ·mol-1
C2H3Cl(g),△H1=-124.8kJ·mol-1
Ⅱ、C2H2(g)+2HCl(g) C2H4Cl2(g),△H2=-179.3kJ·mol-1
C2H4Cl2(g),△H2=-179.3kJ·mol-1
Ⅲ、C2H2(g) 2C(s)+H2(g),△H3=-277.8kJ·mol-1
2C(s)+H2(g),△H3=-277.8kJ·mol-1
较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为P0Pa,10min达到平衡时C2H3Cl(g)、HCl(g)的分压分别为P1Pa、P2Pa。反应Ⅰ的平衡常数Kp=___________ 。
Ⅰ、C2H2(g)+HCl(g)
 C2H3Cl(g),△H1=-124.8kJ·mol-1
C2H3Cl(g),△H1=-124.8kJ·mol-1Ⅱ、C2H2(g)+2HCl(g)
 C2H4Cl2(g),△H2=-179.3kJ·mol-1
C2H4Cl2(g),△H2=-179.3kJ·mol-1Ⅲ、C2H2(g)
 2C(s)+H2(g),△H3=-277.8kJ·mol-1
2C(s)+H2(g),△H3=-277.8kJ·mol-1较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为P0Pa,10min达到平衡时C2H3Cl(g)、HCl(g)的分压分别为P1Pa、P2Pa。反应Ⅰ的平衡常数Kp=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】已知2SO2(g)+ O2(g) 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
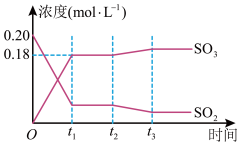
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为___________ mol·L-1·min-1。计算500℃时该反应的平衡常数K=___________ 。
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:图中时刻t2发生改变的条件可能是___________ (写一个即可)。
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程___________ 。(不必求出x)
(4)某温度时,该反应的平衡常数K=5000,则该温度____ 500℃(填“>”、“<”、“=”)。
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y=______ mol。刚开始时反应向_______ (填“正”或“逆”)反应方向进行。
 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:图中时刻t2发生改变的条件可能是
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程
(4)某温度时,该反应的平衡常数K=5000,则该温度
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:

(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___ 。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____ 。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___ (填“是”与“否”),此时υ(正)__ υ(逆)(填“大于”“小于”或“等于”)。

(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态
您最近一年使用:0次
【推荐3】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:
H2(g)+I2(g) 2HI(g) ΔH<0。实验数据如下:
2HI(g) ΔH<0。实验数据如下:
试计算:
(1)容器Ⅰ与容器Ⅱ达平衡时物质的量之比_____________ ;
(2)温度为T时,容器Ⅰ的平衡常数____________ 。(写出解题步骤,计算结果保留3位有效数字)
(3)达平衡时,向容器Ⅰ中同时再通入0.2 mol I2和0.1 mol HI,则此时正、逆反应的相对大小____________ 。(写出解题依据)
(4)能否计算容器Ⅱ平衡时HI的分解率?____________ (写出解题步骤,不必计算结果)
H2(g)+I2(g)
 2HI(g) ΔH<0。实验数据如下:
2HI(g) ΔH<0。实验数据如下:| 容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
| c(H2) | c(I2) | c(HI) | ||
| Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(HI)=0.06 mol·L-1 |
| Ⅱ(恒压) | 0 | 0 | 0.6 | |
试计算:
(1)容器Ⅰ与容器Ⅱ达平衡时物质的量之比
(2)温度为T时,容器Ⅰ的平衡常数
(3)达平衡时,向容器Ⅰ中同时再通入0.2 mol I2和0.1 mol HI,则此时正、逆反应的相对大小
(4)能否计算容器Ⅱ平衡时HI的分解率?
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】在100℃时,将0.01mol的四氧化二氮气体充入0.1L的密闭容器中,发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
请填空:
(1)该反应的化学方程式为____________ 。达到平衡时N2O4的转化率为____________ ,表中c2____________ c3;a____________ b(填“>”“<”或“=”)。
(2)在0~20s内,N2O4的平均反应速率为____________ 。
时间/s 浓度/(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(NO2) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
请填空:
(1)该反应的化学方程式为
(2)在0~20s内,N2O4的平均反应速率为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
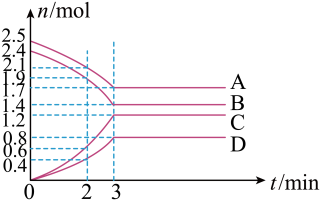
回答下列问题:
①该反应的化学方程式为___ 。
②前2min用A的浓度变化表示的化学反应速率为__ 。在2min时,图像发生改变的原因可能是__ (填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:
①该反应的化学方程式__ ,达到平衡时N2O4的转化率为__ 。
②在0~20s内,四氧化二氮的平均反应速率为__ 。

回答下列问题:
①该反应的化学方程式为
②前2min用A的浓度变化表示的化学反应速率为
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
| c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式
②在0~20s内,四氧化二氮的平均反应速率为
您最近一年使用:0次
【推荐3】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)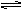 C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)该温度下,该反应的化学平衡常数K=________________ 。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________ ,通过计算说明此时,该反应是否达到了平衡状态__________ ?
 C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是
您最近一年使用:0次

 2C(g),10min后达平衡时,在相同温度下测得容器内混合气体的物质的量是反应前的5/6,试计算
2C(g),10min后达平衡时,在相同温度下测得容器内混合气体的物质的量是反应前的5/6,试计算

