水污染的防治、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醚:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
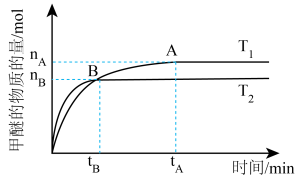
(1)在容积为2 L密闭容器中合成甲醇;其他条件不变的情况下,考查温度对反应的影响,如图所示
①该反应的ΔH________ 0;ΔS______ 0(填“>”、“<”或“=”)。
②下列措施可增加甲醚产率的是_____________ 。
A.升高温度 B.将CH3OCH3(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
③温度为T1时,从反应开始到平衡,生成甲醚的平均速率为___________________ 。
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2合成甲醚
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______ (填“a”或“b”)。
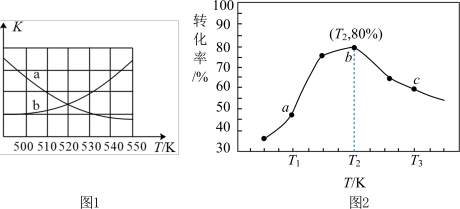
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为___________ 。
 CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)在容积为2 L密闭容器中合成甲醇;其他条件不变的情况下,考查温度对反应的影响,如图所示
①该反应的ΔH
②下列措施可增加甲醚产率的是
A.升高温度 B.将CH3OCH3(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
③温度为T1时,从反应开始到平衡,生成甲醚的平均速率为
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2合成甲醚
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
更新时间:2019-07-03 15:59:09
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)x=________ 。
(2)从开始反应至达到平衡状态,生成C的平均反应速率为________ 。
(3)A的转化率与B的转化率之比为________ 。
(4)平衡后A的体积分数为:___________ 。
(5)反应前与平衡后的压强之比为________ 。
 xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。(1)x=
(2)从开始反应至达到平衡状态,生成C的平均反应速率为
(3)A的转化率与B的转化率之比为
(4)平衡后A的体积分数为:
(5)反应前与平衡后的压强之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在一个容积固定为2L的密闭容器中进行下列反应。
(1)将1 mol N2O4放入此容器,N2O4发生如下反应:N2O4(g) 2NO2(g)(正反应吸热),平衡时,测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍,此时N2O4的体积分数为Φ。平衡时容器内NO2和N2O4的物质的量之比为
2NO2(g)(正反应吸热),平衡时,测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍,此时N2O4的体积分数为Φ。平衡时容器内NO2和N2O4的物质的量之比为______________ ;升高温度,N2O4的转化率______________ (增大或减小);
(2) 恒温时,向此容器内加入1 mol NO2,发生如下反应:2NO2(g) N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1 mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1 mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数______________ 。
A. ①②都增大 B. ①②都减小 C. ①增大,②减小 D. ②增大,①减小
(3) 恒温时,向此容器内加入x mol NO2 和y mol N2O4(y≥0),若要使平衡后N2O4的体积分数仍为Φ,且反应朝着逆反应方向进行,则x的取值范围是___________________ 。
(1)将1 mol N2O4放入此容器,N2O4发生如下反应:N2O4(g)
 2NO2(g)(正反应吸热),平衡时,测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍,此时N2O4的体积分数为Φ。平衡时容器内NO2和N2O4的物质的量之比为
2NO2(g)(正反应吸热),平衡时,测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍,此时N2O4的体积分数为Φ。平衡时容器内NO2和N2O4的物质的量之比为(2) 恒温时,向此容器内加入1 mol NO2,发生如下反应:2NO2(g)
 N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1 mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1 mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数A. ①②都增大 B. ①②都减小 C. ①增大,②减小 D. ②增大,①减小
(3) 恒温时,向此容器内加入x mol NO2 和y mol N2O4(y≥0),若要使平衡后N2O4的体积分数仍为Φ,且反应朝着逆反应方向进行,则x的取值范围是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某化工厂利用CH4制取CO和H2,其生产流程如图。回答下列问题:
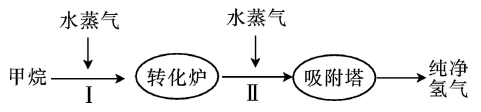
(1)该流程中第Ⅰ步反应为CH4(g)+H2O(g)⇌ CO(g)+3H2(g) ∆H,一定条件下,CH4的平衡转化率与温度、压强的关系如图,则P1______ (填“ ”“
”“ ”或“
”或“ ”,下同) P2,∆H
”,下同) P2,∆H ______ 0。
(2)该流程中第Ⅱ步反应的平衡常数随温度的变化如下表:
①据上表信息分析判断,该反应的∆H ______ (填“ ”“
”“ ”或“
”或“ ”)0。
”)0。
②写出第Ⅱ步反应的化学方程式:______ 。在830℃时,设起始时CO和H2O(g)的浓度均为0.10mol/L,在该条件下反应达到平衡时,CO的转化率为______ 。

(1)该流程中第Ⅰ步反应为CH4(g)+H2O(g)⇌ CO(g)+3H2(g) ∆H,一定条件下,CH4的平衡转化率与温度、压强的关系如图,则P1
 ”“
”“ ”或“
”或“ ”,下同) P2,∆H
”,下同) P2,∆H 
(2)该流程中第Ⅱ步反应的平衡常数随温度的变化如下表:
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |
 ”“
”“ ”或“
”或“ ”)0。
”)0。②写出第Ⅱ步反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Ⅰ.甲烷干重整是制备CO和H2的一种方法,其原理如下
主反应:①CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1
副反应:②H2(g)+CO2(g) CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1
③CH4(g) C(s)+2H2(g) △H3=+75kJ•mol-1
C(s)+2H2(g) △H3=+75kJ•mol-1
④2CO(g) C(s)+CO2(g) △H4=-172kJ•mol-1
C(s)+CO2(g) △H4=-172kJ•mol-1
(1)主反应①△H1=_______ kJ•mol-1。
(2)反应①、②、③、④的△G关于T的关系如图所示,其中反应④对应图为______ (填a,b,c,d)。其中:△G=△H-T△S。
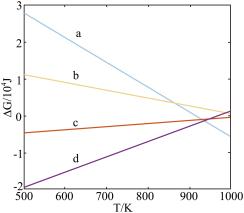
(3)在温度1000K时,假设只发生反应①和②,忽略反应③和反应④。向100KPa恒压密闭体系中充入1molCH4和3molCO2,达到平衡时测得CO和H2物质的量分别为1.5mol和0.5mol,则反应①的平衡常数Kp=_______ kPa2。(对于气相反应,用某组分B的平衡分压p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p•x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)
Ⅱ.甲烷干重整可制得H2与CO,但甲烷干重整反应中,催化剂容易积碳和烧结,引起催化剂失活。有课题组研究Ni催化甲烷干重整反应,某温度下研究了在不同反应物投料比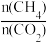 以一定流速下通过催化剂表面,检测甲烷转化率随时间的变化曲线,此时只需考虑反应①、②、③:反应④几乎不发生。
以一定流速下通过催化剂表面,检测甲烷转化率随时间的变化曲线,此时只需考虑反应①、②、③:反应④几乎不发生。
(4)以下两条曲线分别为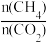 =1:1.1,1∶1.3情况下的曲线,请结合信息解释为什么两条曲线随时间均下降且1∶1.3投料比时转化率高
=1:1.1,1∶1.3情况下的曲线,请结合信息解释为什么两条曲线随时间均下降且1∶1.3投料比时转化率高______ ?

(5)画出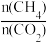 =1:1.1,1∶1.3条件下,CO2转化率曲线随时间变化曲线并标注
=1:1.1,1∶1.3条件下,CO2转化率曲线随时间变化曲线并标注______ 。(已知:反应②活化能远大于反应①)

(6)Bodrov和Apelbaoom等提出了在镍基催化剂上的甲烷干重整的反应机理,以下为反应机理方程式:(*代表催化剂)请补充完整:
①CH4+*=H2+CH2*
②______
③H2+O*=H2O+*
④______
⑤CO*=*+CO
主反应:①CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1副反应:②H2(g)+CO2(g)
 CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1③CH4(g)
 C(s)+2H2(g) △H3=+75kJ•mol-1
C(s)+2H2(g) △H3=+75kJ•mol-1④2CO(g)
 C(s)+CO2(g) △H4=-172kJ•mol-1
C(s)+CO2(g) △H4=-172kJ•mol-1(1)主反应①△H1=
(2)反应①、②、③、④的△G关于T的关系如图所示,其中反应④对应图为

(3)在温度1000K时,假设只发生反应①和②,忽略反应③和反应④。向100KPa恒压密闭体系中充入1molCH4和3molCO2,达到平衡时测得CO和H2物质的量分别为1.5mol和0.5mol,则反应①的平衡常数Kp=
Ⅱ.甲烷干重整可制得H2与CO,但甲烷干重整反应中,催化剂容易积碳和烧结,引起催化剂失活。有课题组研究Ni催化甲烷干重整反应,某温度下研究了在不同反应物投料比
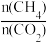 以一定流速下通过催化剂表面,检测甲烷转化率随时间的变化曲线,此时只需考虑反应①、②、③:反应④几乎不发生。
以一定流速下通过催化剂表面,检测甲烷转化率随时间的变化曲线,此时只需考虑反应①、②、③:反应④几乎不发生。(4)以下两条曲线分别为
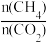 =1:1.1,1∶1.3情况下的曲线,请结合信息解释为什么两条曲线随时间均下降且1∶1.3投料比时转化率高
=1:1.1,1∶1.3情况下的曲线,请结合信息解释为什么两条曲线随时间均下降且1∶1.3投料比时转化率高
(5)画出
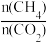 =1:1.1,1∶1.3条件下,CO2转化率曲线随时间变化曲线并标注
=1:1.1,1∶1.3条件下,CO2转化率曲线随时间变化曲线并标注
(6)Bodrov和Apelbaoom等提出了在镍基催化剂上的甲烷干重整的反应机理,以下为反应机理方程式:(*代表催化剂)请补充完整:
①CH4+*=H2+CH2*
②
③H2+O*=H2O+*
④
⑤CO*=*+CO
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】在容积相同的密闭容器中,分别充入等量的氮气和氢气,在不同温度下发生反应:N2(g)+3H2(g) 2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图像如图所示,请回答:
2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图像如图所示,请回答:
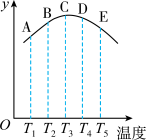
(1)A,B,C,D,E五点中,肯定未达平衡的点是_______ 。
(2)此可逆反应的正反应是_______ 热反应。
(3)AC曲线是增函数曲线,CE曲线是减函数曲线,试从化学反应速率和化学平衡的角度分析,并说明理由_______
 2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图像如图所示,请回答:
2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图像如图所示,请回答:
(1)A,B,C,D,E五点中,肯定未达平衡的点是
(2)此可逆反应的正反应是
(3)AC曲线是增函数曲线,CE曲线是减函数曲线,试从化学反应速率和化学平衡的角度分析,并说明理由
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
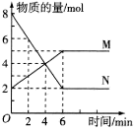
(1)反应的化学方程式为___________ 。
(2)反应达到最大限度的时间是___________ min,该时间内的平均反应速率v(N)=___________ ,v(M)=___________ 。
(3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1molN时,反应放出的热量为___________ (填序号)
A.等于10kJ B.小于10kJ C.大于10kJ D.等于20kJ
(4)判断该反应达到平衡状态的依据是___________ (填序号)
A.该条件下,正、逆反应速率都为零
B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化
D.条件下,单位时间内消耗2molN的同时,消耗1molM
(5)能加快反应速率的措施是___________ (填序号)
A.升高温度B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体ArD.使用催化剂

(1)反应的化学方程式为
(2)反应达到最大限度的时间是
(3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1molN时,反应放出的热量为
A.等于10kJ B.小于10kJ C.大于10kJ D.等于20kJ
(4)判断该反应达到平衡状态的依据是
A.该条件下,正、逆反应速率都为零
B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化
D.条件下,单位时间内消耗2molN的同时,消耗1molM
(5)能加快反应速率的措施是
A.升高温度B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体ArD.使用催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 CO2和H2 在铁系催化剂作用下发生化学反应:
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH1
C2H4(g)+4H2O(g)ΔH1
II.CO2(g) + H2(g) CO(g) + H2O(g)ΔH2 >0
CO(g) + H2O(g)ΔH2 >0
请回答下列问题:
(1)反应I能自发进行,则 ΔH1______ 0(填“<”或“>”或“=”);该反应自发进行的条件是______ 。(填“低温”、“高温”或“任意温度”)
(2)一定条件下的密闭容器中,反应I达到平衡,要提高CO2的转化率。可以采取的措施是___________ (填字母)。
A 减小压强 B 增大H2的浓度 C 加入适当催化剂 D 分离出H2O(g)
(3)在1 L密闭容器中通入1 mol CO2和 3 mol H2 ,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图1所示,点M(350,70),此时乙烯的选择性为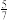 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =___________ 。
(4)在密闭容器中通入1 mol CO2和 3 mol H2 ,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图1所示。温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因___________ 。
I.2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)ΔH1
C2H4(g)+4H2O(g)ΔH1II.CO2(g) + H2(g)
 CO(g) + H2O(g)ΔH2 >0
CO(g) + H2O(g)ΔH2 >0请回答下列问题:
(1)反应I能自发进行,则 ΔH1
(2)一定条件下的密闭容器中,反应I达到平衡,要提高CO2的转化率。可以采取的措施是
A 减小压强 B 增大H2的浓度 C 加入适当催化剂 D 分离出H2O(g)
(3)在1 L密闭容器中通入1 mol CO2和 3 mol H2 ,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图1所示,点M(350,70),此时乙烯的选择性为
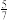 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(4)在密闭容器中通入1 mol CO2和 3 mol H2 ,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图1所示。温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1) 根据所学化学反应原理填空:
①升高温度时,水的pH________ (填“增大”“减小”或“不变”)
②体积、pH均相同的盐酸和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1_______ V2(填“<”、“>”或“=”)
③某反应放热且熵增加,该反应_________ 自发进行(用“能”或“不能”表示)
(2)依据事实,用化学用语填空:
①1 mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量46 kJ。该反应的热化学方程式______________________________________ 。
②用离子方程式表示氯化铵溶液的酸碱性:_________________________________ 。
③用离子方程式表示向碳酸镁沉淀中加入NaOH溶液后的沉淀转化:
_______________________________________________________ 。
①升高温度时,水的pH
②体积、pH均相同的盐酸和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1
③某反应放热且熵增加,该反应
(2)依据事实,用化学用语填空:
①1 mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量46 kJ。该反应的热化学方程式
②用离子方程式表示氯化铵溶液的酸碱性:
③用离子方程式表示向碳酸镁沉淀中加入NaOH溶液后的沉淀转化:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】节能减排是指节约物质资源和能量资源,减少废弃物和环境有害物的排放。
(1)实现“节能减排”和“低碳经济”的项重要课题就是如何将 转化为可利用的资源。目前工业上有一种方法是用
转化为可利用的资源。目前工业上有一种方法是用 来生产燃料甲醇,一定条件下发生反应:
来生产燃料甲醇,一定条件下发生反应:
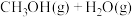 ,如图所示为该反应过程中的能量
,如图所示为该反应过程中的能量 变化:
变化:

下列关于该反应的说法正确的是_____________ (填序号)。
A.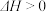 ,
, B.
B.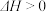 ,
,
C. ,
, D.
D. ,
,
(2)将煤加工成水煤气可降低污染并提高燃料的利用率。将水蒸气通过红热的炭即产生水煤气,反应方程式为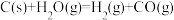 ,该反应的
,该反应的 ,
,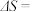
 。该反应在常温下
。该反应在常温下_____________ (填“能”或“不能”)自发进行。
(1)实现“节能减排”和“低碳经济”的项重要课题就是如何将
 转化为可利用的资源。目前工业上有一种方法是用
转化为可利用的资源。目前工业上有一种方法是用 来生产燃料甲醇,一定条件下发生反应:
来生产燃料甲醇,一定条件下发生反应:
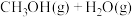 ,如图所示为该反应过程中的能量
,如图所示为该反应过程中的能量 变化:
变化:
下列关于该反应的说法正确的是
A.
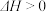 ,
, B.
B.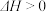 ,
,
C.
 ,
, D.
D. ,
,
(2)将煤加工成水煤气可降低污染并提高燃料的利用率。将水蒸气通过红热的炭即产生水煤气,反应方程式为
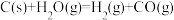 ,该反应的
,该反应的 ,
,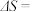
 。该反应在常温下
。该反应在常温下
您最近一年使用:0次



