信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
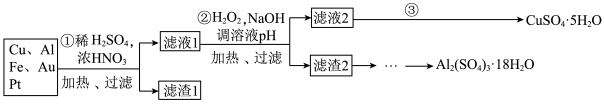
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________ ;得到滤渣1的主要成分为__________ 。
(2)第②步中加H2O2的作用是__________ ,使用H2O2的优点是__________ ;调溶液pH的目的是使__________ 生成沉淀。
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是__________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2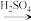 酸浸液
酸浸液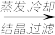 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
乙:滤渣2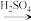 酸浸液
酸浸液 滤液
滤液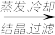 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
丙:滤渣2 滤液
滤液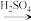 溶液
溶液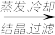 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
上述三种方案中,__________ 方案不可行,原因是__________ ;
从原子利用率角度考虑,__________ 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=__________ ;
②下列操作会导致含量的测定结果偏高的是______ 。
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
(2)第②步中加H2O2的作用是
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2
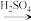 酸浸液
酸浸液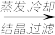 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O乙:滤渣2
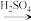 酸浸液
酸浸液 滤液
滤液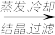 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O丙:滤渣2
 滤液
滤液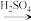 溶液
溶液 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O上述三种方案中,
从原子利用率角度考虑,
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=
②下列操作会导致含量的测定结果偏高的是
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子
更新时间:2019-05-09 16:01:33
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:

试回答下列问题:
(1)试剂X为__________ ;
(2)操作Ⅰ、操作Ⅱ均为_____________ (填操作名称),在实验室进行该操作时需要的玻璃仪器有__________________________________ ;
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为___________________ ,请举一例该反应的用途________________________ ;
(4)反应Ⅱ的离子方程式为________________________________ ;
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________ g。

试回答下列问题:
(1)试剂X为
(2)操作Ⅰ、操作Ⅱ均为
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为
(4)反应Ⅱ的离子方程式为
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
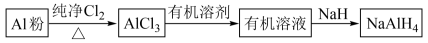
(1)制备无水AlCl:
实验装置如下。已知AlCl3178℃升华,在潮湿的空气中易水解。

①实验时应先点燃_______ ( 填“A”或“D”)处酒精灯,当观察到_______ 时,再点燃另一处酒精灯。
②装置F的作用是_________________ 。
(2)制取铝氢化钠
制取铝氢化钠的化学方程式是_________________ , AlCl3配成有机溶液的目的是__________ 。
(3)铝氢化钠样品性质探究和纯度测定
①称取一定质量实验制得的铝氢化钠样品( 除含产物杂质外,还可能含有过量的NaH),滴加足量的水,观察到产生气体,该气体是________________ 。
②向反应后的溶液中滴加酚酞,溶液变红。猜想可能是生成了NaOH 呈碱性,也可能
是_________________ 。为验证猜想,可再逐滴滴加盐酸并振荡,当观察到____________ 时,即可证明两种猜想均成立。
③设计如下两种装置测定生成气体的体积(若其他操作一致),用甲装置测得铝氢化钠的含量________ 乙装 置。 (填“大于”、“小于”或“等于”)。
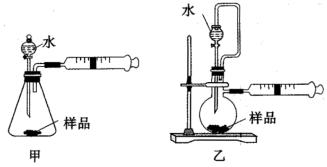

(1)制备无水AlCl:
实验装置如下。已知AlCl3178℃升华,在潮湿的空气中易水解。

①实验时应先点燃
②装置F的作用是
(2)制取铝氢化钠
制取铝氢化钠的化学方程式是
(3)铝氢化钠样品性质探究和纯度测定
①称取一定质量实验制得的铝氢化钠样品( 除含产物杂质外,还可能含有过量的NaH),滴加足量的水,观察到产生气体,该气体是
②向反应后的溶液中滴加酚酞,溶液变红。猜想可能是生成了NaOH 呈碱性,也可能
是
③设计如下两种装置测定生成气体的体积(若其他操作一致),用甲装置测得铝氢化钠的含量

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。
放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究。
已知 :①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+。
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的正极反应式为;_______________________________________ ;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作______________ s。(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:
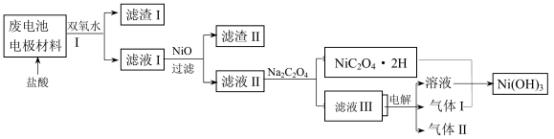
①方案中加入适量双氧水的目的是____________ ;在滤液I中慢慢加入NiO固体,则依次析出沉淀
________ 和沉淀__________ (填化学式)。若两种沉淀都析出,pH应控制在不超过______________
(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_______________________________________________________ 。
②滤液III中溶质的主要成分是___________ (填化学式);气体I为___________ ,判断依据是_________________________________________________________________________ 。
放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究。
已知 :①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+。
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
回答下列问题:
(1)该电池的正极反应式为;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作
(3)对该电池电极材料进行回收方案设计:

①方案中加入适量双氧水的目的是
(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案
②滤液III中溶质的主要成分是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】为探究CO还原CuO的固体产物成分,某同学用以下装置(夹持装置已省略)进行有关实验:
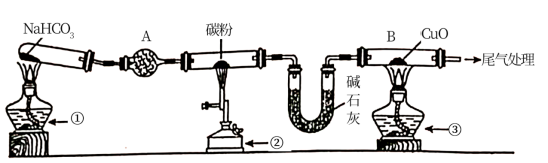
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是___ 。
(2)点燃①、②、③的先后顺序是①→____ →____ 。
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?___ (填“能”或“不能”),理由是___ 。

已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是
(2)点燃①、②、③的先后顺序是①→
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3 溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】称取 12.5 g 胆矾溶于 87.4 mL 蒸馏水中,滴 4 滴稀硫酸,充分搅拌后得到 CuSO4溶液。向其中加入适 量 Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是______________________ 。所得硫酸铜溶液的溶质质量分数约 为______________________ 。
(2)用无水乙醇洗涤的目的是______________________ 。
【实验探究】同学们设计了如下装置,用制得的蓝绿色固体进行实验:
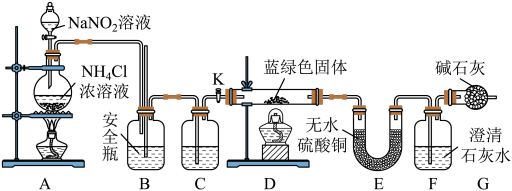
(3)D 装置加热前,需要首先打开活塞 K,用 A 装置制取适量 N2,然后关闭 K,点燃 D 处酒精灯。A 中产生N2的作用是______________________ ,C 中盛装的试剂应是______________________ 。
(4)装置 A 中发生反应的离子方程式为______________________ 。
(5)若蓝绿色固体的组成为 xCuCO3·yCu(OH)2,实验能观察到的现象是_______________________________________ 。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用 Ba(OH)2代替 Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是______________ 。
a.Ba(OH)2的碱性比 Ca(OH)2强
b.Ba(OH)2溶解度大于 Ca(OH)2,能充分吸收 CO2;
c.相同条件下,CaCO3 的溶解度明显大于 BaCO3
d.吸收等量 CO2生成的 BaCO3的质量大于 CaCO3,测量误差小
待 D 中反应完全后,打开活塞 K,再次滴加 NaNO2溶液产生 N2,其目的是________________________________________ 。若定量分析所取蓝绿色固体质量为 27.1 g,装置 F 中使用 Ba(OH)2溶液,实验结束后, 装置 E 的质量增加 2.7 g,F 中产生沉淀 19.7 g。则该蓝绿色固体的化学式为 ____________________ 。
【沉淀制备】称取 12.5 g 胆矾溶于 87.4 mL 蒸馏水中,滴 4 滴稀硫酸,充分搅拌后得到 CuSO4溶液。向其中加入适 量 Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是
(2)用无水乙醇洗涤的目的是
【实验探究】同学们设计了如下装置,用制得的蓝绿色固体进行实验:

(3)D 装置加热前,需要首先打开活塞 K,用 A 装置制取适量 N2,然后关闭 K,点燃 D 处酒精灯。A 中产生N2的作用是
(4)装置 A 中发生反应的离子方程式为
(5)若蓝绿色固体的组成为 xCuCO3·yCu(OH)2,实验能观察到的现象是
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用 Ba(OH)2代替 Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是
a.Ba(OH)2的碱性比 Ca(OH)2强
b.Ba(OH)2溶解度大于 Ca(OH)2,能充分吸收 CO2;
c.相同条件下,CaCO3 的溶解度明显大于 BaCO3
d.吸收等量 CO2生成的 BaCO3的质量大于 CaCO3,测量误差小
待 D 中反应完全后,打开活塞 K,再次滴加 NaNO2溶液产生 N2,其目的是
您最近一年使用:0次
【推荐3】氯化亚铜( )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产
)生产 的流程如图所示:
的流程如图所示:
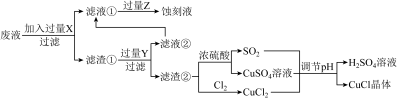
根据以上信息回答下列问题:
(1)生产过程中:X是________ ,Z是________ 。(均填化学式)
(2)写出生成 的离子方程式
的离子方程式________ 。
(3)析出的 晶体不用水而用无水乙醇洗涤的原因是
晶体不用水而用无水乙醇洗涤的原因是________ 。
(4)在 的生成过程中理论上不需要补充SO2气体,其理由是
的生成过程中理论上不需要补充SO2气体,其理由是________ 。
(5)已知:常温下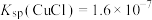 ,
,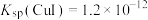 ,现向
,现向 饱和溶液中加入
饱和溶液中加入 固体至
固体至 ,此时溶液中
,此时溶液中 =
=________ 。
(6)实验探究pH对 产率的影响如下表所示:
产率的影响如下表所示:
析出 晶体最佳pH为
晶体最佳pH为________ ,当pH较大时 产率变低的原因是
产率变低的原因是________ 。
 )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产
)生产 的流程如图所示:
的流程如图所示:
根据以上信息回答下列问题:
(1)生产过程中:X是
(2)写出生成
 的离子方程式
的离子方程式(3)析出的
 晶体不用水而用无水乙醇洗涤的原因是
晶体不用水而用无水乙醇洗涤的原因是(4)在
 的生成过程中理论上不需要补充SO2气体,其理由是
的生成过程中理论上不需要补充SO2气体,其理由是(5)已知:常温下
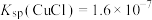 ,
,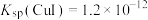 ,现向
,现向 饱和溶液中加入
饱和溶液中加入 固体至
固体至 ,此时溶液中
,此时溶液中 =
=(6)实验探究pH对
 产率的影响如下表所示:
产率的影响如下表所示:| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出
 晶体最佳pH为
晶体最佳pH为 产率变低的原因是
产率变低的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】铅的单质、氧化物、盐在现代T业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式:___ 。
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:

(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为____ 。 “脱硫过程”可在如图所示的装置中进行。实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。

①仪器a的名称是____ ;转化温度为35℃,采用的合适加热方式是____ 。
②步骤②中H2O2的作用是____ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A___ (填装置字母代号),证明产物中有CO气体的实验现象是____ 。

(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为____ ,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14. 52 mL。
①若滴定管未用EDTA标准液润洗,测定结果将___ (填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为___ (保留四位有效数字)。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式:
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:

(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为

①仪器a的名称是
②步骤②中H2O2的作用是
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A

(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为
①若滴定管未用EDTA标准液润洗,测定结果将
②草酸铅的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】 是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼(
是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼( )和氢氧化钠溶液对酸性
)和氢氧化钠溶液对酸性 蚀刻废液进行综合回收利用,进行
蚀刻废液进行综合回收利用,进行 的制备和NaCl的回收工艺流程如图所示。
的制备和NaCl的回收工艺流程如图所示。
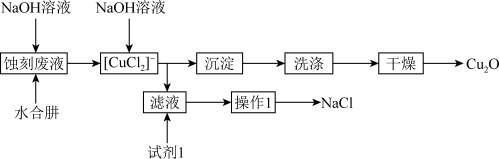
已知: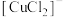 易发生歧化反应。CuOH不稳定,易失水,
易发生歧化反应。CuOH不稳定,易失水,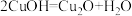 。
。
回答下列问题:
(1)两次加入NaOH溶液的作用分别是:第一次_______ ;第二次_______ 。
(2)验证沉淀已洗涤干净的操作及现象为_______ 。
(3)试剂1为_______ ,操作1为_______ 。
(4)每生成1mol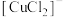 消耗水合肼的物质的量为
消耗水合肼的物质的量为_______ ,用水合肼( )和氢氧化钠溶液进行
)和氢氧化钠溶液进行 制备的总反应的化学方程式为
制备的总反应的化学方程式为_______ 。
(5)已知所制备 的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得
的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得 可能混杂的杂质为
可能混杂的杂质为_______ ,产生该杂质的原因是_______ (用必要的化学用语解释)。
 是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼(
是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼( )和氢氧化钠溶液对酸性
)和氢氧化钠溶液对酸性 蚀刻废液进行综合回收利用,进行
蚀刻废液进行综合回收利用,进行 的制备和NaCl的回收工艺流程如图所示。
的制备和NaCl的回收工艺流程如图所示。
已知:
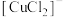 易发生歧化反应。CuOH不稳定,易失水,
易发生歧化反应。CuOH不稳定,易失水,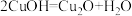 。
。回答下列问题:
(1)两次加入NaOH溶液的作用分别是:第一次
(2)验证沉淀已洗涤干净的操作及现象为
(3)试剂1为
(4)每生成1mol
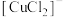 消耗水合肼的物质的量为
消耗水合肼的物质的量为 )和氢氧化钠溶液进行
)和氢氧化钠溶液进行 制备的总反应的化学方程式为
制备的总反应的化学方程式为(5)已知所制备
 的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得
的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得 可能混杂的杂质为
可能混杂的杂质为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是__________________________ 。
(2)操作II中,通入硫化氢至饱和的目的是_________________________________ ;在溶液中用硫酸酸化至pH=2的目的是___________________________________________ 。
(3)操作IV的顺序依次为:_________________ 、冷却结晶、__________________ 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________ 。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:___________________ 。
②判断此滴定实验达到终点的方法是_______________________________________ 。
③计算上述样品中FeSO4·7H2O的质量分数为_________ (用小数表示,保留三位小数)。

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是
(2)操作II中,通入硫化氢至饱和的目的是
(3)操作IV的顺序依次为:
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:
②判断此滴定实验达到终点的方法是
③计算上述样品中FeSO4·7H2O的质量分数为
您最近一年使用:0次



