常温下,下列说法正确的是
| A.含有CH3COOH与CH3COONa的混合液一定呈酸性 |
| B.在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等 |
| C.体积相等、pH值相等的CH3COOH和盐酸与Zn反应,开始时盐酸放出H2快 |
| D.中和相同体积、相同浓度的CH3COOH溶液和盐酸,消耗的NaOH的物质的量相等 |
18-19高二下·浙江·期末 查看更多[3]
更新时间:2019-08-10 22:16:05
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中相差不大。以下是某温度下这四种酸在冰醋酸中的电离平衡常数,根据下面表格中的数据判断以下说法中不正确的是
| 醋 | 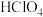 |  | HCl | 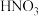 |
| Ka | 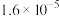 | 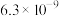 | 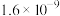 | 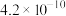 |
| A.水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱 |
B.在冰醋酸中,硫酸的电离方程式可表示为 , , |
C.在冰醋酸中,1mol/L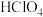 的电离度约为0.4% 的电离度约为0.4% |
D.在冰醋酸中, 是这四种酸中酸性最强的酸 是这四种酸中酸性最强的酸 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列关于电解质溶液的叙述正确的是
| A.室温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
D.室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】有pH=2的X、Y、Z三种酸的溶液各1mL,分别向其中加水稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法正确的是


| A.Y的酸性强于Z |
| B.X、Y、Z均为弱酸 |
C.稀释前的浓度大小为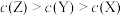 |
D.稀释后的浓度大小为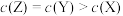 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】柱状图可以直观地表示水溶液中微粒的种类和浓度。关于下图中盐酸和醋酸的说法正确的是
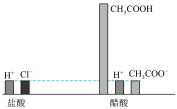

A.两种溶液中 :盐酸<醋酸 :盐酸<醋酸 |
B.加水稀释同等倍数后,盐酸 更大 更大 |
C.两溶液浓度: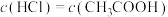 |
D.用两溶液中和相同物质的量的 时,所需盐酸的体积小 时,所需盐酸的体积小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列解释事实的方程式不正确 的是
A.用惰性电极电解 溶液,阴极有气体生成: 溶液,阴极有气体生成: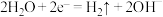 |
B.向 沉淀中加入盐酸,沉淀溶解: 沉淀中加入盐酸,沉淀溶解: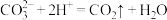 |
C.常温下,测得 溶液 溶液 约为13: 约为13: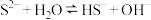 |
D.向 悬浊液中滴加 悬浊液中滴加 溶液,沉淀颜色变为红褐色: 溶液,沉淀颜色变为红褐色: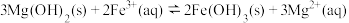 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】有关FeCl3变色反应的叙述正确的是( )
①向FeCl3溶液中滴入紫色石蕊试液,溶液变成红色
②向FeCl3溶液中通入H2S气体,生成淡黄色沉淀
③将FeCl3溶液滴入到淀粉碘化钾溶液中,溶液变成蓝色
①向FeCl3溶液中滴入紫色石蕊试液,溶液变成红色
②向FeCl3溶液中通入H2S气体,生成淡黄色沉淀
③将FeCl3溶液滴入到淀粉碘化钾溶液中,溶液变成蓝色
| A.①②③ | B.①③ | C.②③ | D.①② |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】T℃时,水的离子积为Kw,该温度下将x mol·L-1的一元酸HCl与y mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必须满足的条件是
| A.混合液中c(B+)=c(Cl-)+c(OH-) |
| B.混合液的pH=7 |
C.混合液中c(OH-)=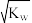 |
| D.x=y |
您最近一年使用:0次

 通入滴有酚酞的NaOH溶液中红色褪去,证明
通入滴有酚酞的NaOH溶液中红色褪去,证明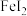 浓溶液中滴加2滴氯水,溶液变蓝,证明
浓溶液中滴加2滴氯水,溶液变蓝,证明 还原性强于
还原性强于
 加热分解生成的气体中,木条复燃,证明
加热分解生成的气体中,木条复燃,证明 支持燃烧
支持燃烧

