一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:
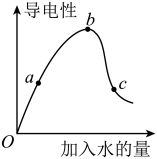
(1)O点为什么不导电_______ 。
(2)a、b、c三点c(H+)由大到小的顺序是_____ 。
(3)a、b、c三点中醋酸的电离程度最大的点是_____ 点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是____ (填标号)。
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水E.加固体CH3COONa F.加锌粉

(1)O点为什么不导电
(2)a、b、c三点c(H+)由大到小的顺序是
(3)a、b、c三点中醋酸的电离程度最大的点是
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水E.加固体CH3COONa F.加锌粉
更新时间:2019-10-28 09:13:48
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)按要求填空:①石墨②CaCO3③盐酸④CO2⑤CaO⑥KOH(熔融)⑦Al(OH)3⑧Fe(NO3)3⑨酒精⑩冰醋酸⑪Ca(OH)2;以上指定物质中,属于非电解质的是_______ 属于强电解质的是_______ 能导电的是_______
(2)书写下列物质的电离方程式
①亚硫酸_______
②氢氧化铁_______
③硫酸钡_______
④硫酸氢钾在水溶液中_______
(3)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,写出表甲醇燃烧热的化学方程式_______ 。
(4)反应N2(g)+3H2(g) 2NH3(g) ΔH=akJ/mol。根据下表中所列键能数据计算a的数值为
2NH3(g) ΔH=akJ/mol。根据下表中所列键能数据计算a的数值为_______ 。
(5)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ/mol
写出:C(s,石墨)和H2(g)生成1molC2H2(g)热化学方程式:_______ 。
(1)按要求填空:①石墨②CaCO3③盐酸④CO2⑤CaO⑥KOH(熔融)⑦Al(OH)3⑧Fe(NO3)3⑨酒精⑩冰醋酸⑪Ca(OH)2;以上指定物质中,属于非电解质的是
(2)书写下列物质的电离方程式
①亚硫酸
②氢氧化铁
③硫酸钡
④硫酸氢钾在水溶液中
(3)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,写出表甲醇燃烧热的化学方程式
(4)反应N2(g)+3H2(g)
 2NH3(g) ΔH=akJ/mol。根据下表中所列键能数据计算a的数值为
2NH3(g) ΔH=akJ/mol。根据下表中所列键能数据计算a的数值为| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391. | 945 |
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ/mol
写出:C(s,石墨)和H2(g)生成1molC2H2(g)热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题
(1)常温下,浓度均为0.1 的五种钠盐溶液的
的五种钠盐溶液的 如下表所示:
如下表所示:
①上述几种钠盐的阴离子,结合氢离子能力最强的是____________ (填离子符号)。
②根据表中数据判断,将浓度均为0.01 的下列四种酸的溶液分别稀释至原体积的100倍,
的下列四种酸的溶液分别稀释至原体积的100倍, 变化最大的是
变化最大的是____________ 。
a. B.
B. C.
C. D.
D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的 如下表所示:
如下表所示:
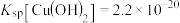 ,
, 。
。
①用150 1
1
 溶液吸收标准状况下的2.24L
溶液吸收标准状况下的2.24L ,所得溶液中各离子的浓度由大到小的顺序为
,所得溶液中各离子的浓度由大到小的顺序为____________ 。
②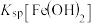
___________ (填“>”“=”或“<”)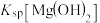 。
。
③当向含有相同浓度的 、
、 、
、 的溶液中滴加
的溶液中滴加 溶液时,
溶液时,_________ (填离子符号)先沉淀。
④要使0.2
 溶液中
溶液中 沉淀完全,则应向溶液中加入
沉淀完全,则应向溶液中加入 溶液使溶液的
溶液使溶液的 不低于
不低于_________ (保留1位小数)。
(1)常温下,浓度均为0.1
 的五种钠盐溶液的
的五种钠盐溶液的 如下表所示:
如下表所示:溶质 |
|
|
|
|
|
| 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述几种钠盐的阴离子,结合氢离子能力最强的是
②根据表中数据判断,将浓度均为0.01
 的下列四种酸的溶液分别稀释至原体积的100倍,
的下列四种酸的溶液分别稀释至原体积的100倍, 变化最大的是
变化最大的是a.
 B.
B. C.
C. D.
D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的
 如下表所示:
如下表所示:离子 |
|
|
|
| 7.6 | 5.2 | 10.1 |
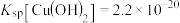 ,
, 。
。①用150
 1
1
 溶液吸收标准状况下的2.24L
溶液吸收标准状况下的2.24L ,所得溶液中各离子的浓度由大到小的顺序为
,所得溶液中各离子的浓度由大到小的顺序为②
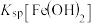
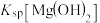 。
。③当向含有相同浓度的
 、
、 、
、 的溶液中滴加
的溶液中滴加 溶液时,
溶液时,④要使0.2

 溶液中
溶液中 沉淀完全,则应向溶液中加入
沉淀完全,则应向溶液中加入 溶液使溶液的
溶液使溶液的 不低于
不低于
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】25℃时,100 mL0.1 mol·L-1的CH3COONa溶液pH为11。
(1)CH3COONa溶液呈碱性的原因是_____ (用离子方程式表示)。
(2)该溶液中水的电离度是相同温度下纯水的_____ 倍。
(3)25℃时,向0.1 mol·L-1醋酸中加入少量醋酸钠固体。当固体溶解后,推测溶液pH变化情况并说明理由。_____
(1)CH3COONa溶液呈碱性的原因是
(2)该溶液中水的电离度是相同温度下纯水的
(3)25℃时,向0.1 mol·L-1醋酸中加入少量醋酸钠固体。当固体溶解后,推测溶液pH变化情况并说明理由。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】次磷酸( )是一种一元中强酸。回答下列问题:
)是一种一元中强酸。回答下列问题:
(1)写出 的电离方程式:
的电离方程式:___ ,室温下, 的次磷酸溶液中,由水电离出的
的次磷酸溶液中,由水电离出的
___  。
。
(2)pH相同的盐酸和次磷酸溶液分别与足量的锌粒反应,生成等量的 时所需时间较短的是
时所需时间较短的是______ 。浓度相同的盐酸和次磷酸溶液分别与足量的锌粒反应,生成等量的 时所需时间较短的是
时所需时间较短的是______ 。
(3)将10mL 的次磷酸溶液稀释至1000mL,溶液的pH
的次磷酸溶液稀释至1000mL,溶液的pH______ (填“>”“<”或“=”)4。
(4)下列措施可使次磷酸溶液的pH增大,并且电离平衡向右移动的是______(填标号)。
(5)亚磷酸(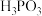 )是二元中强酸,25℃时亚磷酸的电离常数
)是二元中强酸,25℃时亚磷酸的电离常数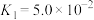 、
、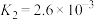 。
。
①当温度升高时,K值______ (填“增大”或“减小”)。
②试从电离平衡移动的角度解释 、
、 数据的差异:
数据的差异:______ 。
 )是一种一元中强酸。回答下列问题:
)是一种一元中强酸。回答下列问题:(1)写出
 的电离方程式:
的电离方程式: 的次磷酸溶液中,由水电离出的
的次磷酸溶液中,由水电离出的
 。
。(2)pH相同的盐酸和次磷酸溶液分别与足量的锌粒反应,生成等量的
 时所需时间较短的是
时所需时间较短的是 时所需时间较短的是
时所需时间较短的是(3)将10mL
 的次磷酸溶液稀释至1000mL,溶液的pH
的次磷酸溶液稀释至1000mL,溶液的pH(4)下列措施可使次磷酸溶液的pH增大,并且电离平衡向右移动的是______(填标号)。
A.加入 溶液 溶液 | B.加入盐酸 | C.加水稀释 | D.升高温度 |
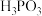 )是二元中强酸,25℃时亚磷酸的电离常数
)是二元中强酸,25℃时亚磷酸的电离常数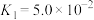 、
、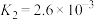 。
。①当温度升高时,K值
②试从电离平衡移动的角度解释
 、
、 数据的差异:
数据的差异:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】根据所学知识,回答下列问题:
Ⅰ.一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图如图所示。

(1)写出醋酸的电离方程式:_______ 。
(2)a、b、c三点的氢离子浓度由小到大的顺序为_______ 。
(3)若要使c点溶液中的 增大,则可采取的措施有
增大,则可采取的措施有_______ 。(任写两点)。
(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是_______。
Ⅱ.已知水在25℃和95℃时,其电离平衡曲线如图所示。

(5)95℃时,将pH=9的NaOH溶液与pH=4的盐酸混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸的体积比为_______ 。
(6)95℃时,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积 的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是_______ 。
(7)25℃时,有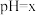 的盐酸和
的盐酸和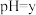 的氢氧化钠溶液(
的氢氧化钠溶液(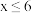 ,
, ),取m L该盐酸与n L该氢氧化钠溶液,反应,恰好完全中和,若
),取m L该盐酸与n L该氢氧化钠溶液,反应,恰好完全中和,若 ,则
,则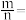
_______ (填表达式)。
Ⅰ.一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图如图所示。

(1)写出醋酸的电离方程式:
(2)a、b、c三点的氢离子浓度由小到大的顺序为
(3)若要使c点溶液中的
 增大,则可采取的措施有
增大,则可采取的措施有(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是_______。
A. | B. 数目 数目 | C. 分子数 分子数 | D. |
Ⅱ.已知水在25℃和95℃时,其电离平衡曲线如图所示。

(5)95℃时,将pH=9的NaOH溶液与pH=4的盐酸混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸的体积比为
(6)95℃时,若100体积
 的某强酸溶液与1体积
的某强酸溶液与1体积 的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是(7)25℃时,有
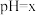 的盐酸和
的盐酸和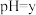 的氢氧化钠溶液(
的氢氧化钠溶液(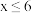 ,
, ),取m L该盐酸与n L该氢氧化钠溶液,反应,恰好完全中和,若
),取m L该盐酸与n L该氢氧化钠溶液,反应,恰好完全中和,若 ,则
,则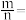
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】25℃时,三种酸的电离平衡常数如下:回答下列问题:
(1)一般情况下,当温度升高时,电离平衡常数K________ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是______ (填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________ (填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO32-+2HClO
(4)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
则HX的电离平衡常数________ (填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____ 醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____ HX。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,电离平衡常数K
(2)下列四种离子结合质子能力最强的是
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO32-+2HClO
(4)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。

则HX的电离平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________ 。
(2)Na2HPO3是____ (填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________ 。
(4)某温度下,0.10 mol•L-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 mol•L-1,该温度下H3PO3的电离平衡常数K1=___________________ ;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____ c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____ c(HPO32-)+c(OH-)。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式
(2)Na2HPO3是
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为
(4)某温度下,0.10 mol•L-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 mol•L-1,该温度下H3PO3的电离平衡常数K1=
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】水是一种极弱的电解质,是生活中一种重要物质,没有水就没有生命。
(1)常温下,0.1mol·L-1的NaOH溶液的pH=___ ;该溶液中由水电离出的H+浓度为____ 。
(2)体积均为100mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积V的关系如图所示,则HX是___ (填“强酸”或“弱酸”)。

(3)常温下,向水中加入少量碳酸钠固体,所得溶液pH为11。该溶液呈碱性的原因是____ (用离子方程式表示)。由水电离出的H+浓度为___ 。
(4)常温下,0.1mol·L-1HA溶液中 =108。
=108。
①在上述HA溶液加水稀释的过程中,随着水量的增加而减小的是___ (填字母)。
A. B.
B. C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
②在体积相等、pH相等的HA溶液与HCl溶液中加入足量Zn,HA溶液中产生的气体比HCl溶液中产生的气体___ (填“多”、“少”或“相等”)。
③已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中加入盐酸,CO 、HCO
、HCO 、A-结合H+的能力由强到弱的顺序是
、A-结合H+的能力由强到弱的顺序是___ 。
(1)常温下,0.1mol·L-1的NaOH溶液的pH=
(2)体积均为100mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积V的关系如图所示,则HX是

(3)常温下,向水中加入少量碳酸钠固体,所得溶液pH为11。该溶液呈碱性的原因是
(4)常温下,0.1mol·L-1HA溶液中
 =108。
=108。①在上述HA溶液加水稀释的过程中,随着水量的增加而减小的是
A.
 B.
B. C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)②在体积相等、pH相等的HA溶液与HCl溶液中加入足量Zn,HA溶液中产生的气体比HCl溶液中产生的气体
③已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中加入盐酸,CO
 、HCO
、HCO 、A-结合H+的能力由强到弱的顺序是
、A-结合H+的能力由强到弱的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】不同温度下,水溶液中 与
与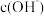 的关系如图所示.回答下列问题:
的关系如图所示.回答下列问题:

(1)T℃_______ 25℃(填“>”、“<”或“=”).
(2)向a点对应的醋酸溶液中滴加等物质的量浓度的NaOH溶液至b点,则两溶液的体积_________ (填“相等”或“不相等”).
(3)d点对应的食盐水
__________ ,呈__________ 性(填“酸”、“中”或“碱”).
(4)将等pH等体积的HCl和 分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m
分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m_______ n(填“大于、等于、小于”).
(5)常温下,将 的NaOH溶液
的NaOH溶液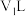 与
与 的
的 溶液
溶液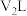 混合,若所得混合溶液的
混合,若所得混合溶液的 ,则
,则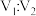 为
为____________ .
(6)常温下,0.05mol/L的 溶液中,由水所电离出的
溶液中,由水所电离出的 为
为___________ .
 与
与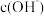 的关系如图所示.回答下列问题:
的关系如图所示.回答下列问题:
(1)T℃
(2)向a点对应的醋酸溶液中滴加等物质的量浓度的NaOH溶液至b点,则两溶液的体积
(3)d点对应的食盐水

(4)将等pH等体积的HCl和
 分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m
分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m(5)常温下,将
 的NaOH溶液
的NaOH溶液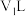 与
与 的
的 溶液
溶液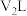 混合,若所得混合溶液的
混合,若所得混合溶液的 ,则
,则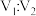 为
为(6)常温下,0.05mol/L的
 溶液中,由水所电离出的
溶液中,由水所电离出的 为
为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有下列物质①100 ℃的纯水 ②25 ℃ 0.1 mol·L-1 HCl溶液 ③25 ℃ 0.1 mol·L-1 KOH溶液 ④25 ℃ 0.1 mol·L-1 Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,能促进水电离的是___ (填序号,下同),能抑制水电离的是___ ,水电离的c(OH-)等于溶液中c(OH-)的是___ ,水电离的c(H+)等于溶液中c(H+)的是___ 。
(2)从②和③溶液中水的电离程度相等,进而可推出的结论是:同一温度下,__________ 时,水的电离程度相等。
(1)这些物质与25 ℃纯水相比,能促进水电离的是
(2)从②和③溶液中水的电离程度相等,进而可推出的结论是:同一温度下,
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请回答下列问题:
(1)某浓度的稀氨水中存在电离平衡: ,若想增大该溶液中
,若想增大该溶液中 的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)
的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)( )
A.适当升高温度 B.加入NH4Cl固体 C.通入NH3 D.加入少量浓盐酸
(2)常温下,有pH相同、体积相同的a.CH3COOH溶液和b.HCl溶液,现采取以下措施:
①分别加适量醋酸钠晶体后,CH3COOH溶液中c(H+)________ (填“增大”“减小”或“不变”,下同),HCl溶液中c(H+)___________ 。
②分别加水稀释10倍后,CH3COOH溶液中的c(H+)_______ (填“>”“=”或“<”)HCl溶液中的c(H+)。
③分别加等浓度的NaOH溶液至恰好反应,所需NaOH溶液的体积:CH3COOH溶液______ (填“>”“=”或“<”)HCl溶液。
④温度都升高20℃,CH3COOH溶液中c(H+)_______ (填“>”“=”或“<”)HCl溶液中c(H+)。
(3)将0.1 mol/L的CH3COOH溶液加水稀释,下列有关稀释后CH3COOH溶液的说法正确的是( )
A.电离程度增大 B.溶液中离子总数增多
C.溶液导电性增强 D.溶液中醋酸分子增多
(1)某浓度的稀氨水中存在电离平衡:
 ,若想增大该溶液中
,若想增大该溶液中 的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)
的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)A.适当升高温度 B.加入NH4Cl固体 C.通入NH3 D.加入少量浓盐酸
(2)常温下,有pH相同、体积相同的a.CH3COOH溶液和b.HCl溶液,现采取以下措施:
①分别加适量醋酸钠晶体后,CH3COOH溶液中c(H+)
②分别加水稀释10倍后,CH3COOH溶液中的c(H+)
③分别加等浓度的NaOH溶液至恰好反应,所需NaOH溶液的体积:CH3COOH溶液
④温度都升高20℃,CH3COOH溶液中c(H+)
(3)将0.1 mol/L的CH3COOH溶液加水稀释,下列有关稀释后CH3COOH溶液的说法正确的是
A.电离程度增大 B.溶液中离子总数增多
C.溶液导电性增强 D.溶液中醋酸分子增多
您最近一年使用:0次







