海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:
(1)氯离子原子核外有___ 种不同运动状态的电子,有___ 种不同能量的电子,共占据了___ 个轨道。
(2)溴在周期表中的位置___ 。HI的稳定性比HBr___ (填写“强”或“弱”)。
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是___ 。
②还原性按Cl-、Br-、I-的顺序依次增大,原因是___ 。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是___ ,氧化产物___ 。(填离子符号)
(5)HClO有很好的杀菌消毒效果,为增强氯水的杀菌消毒能力,可用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因___ 。
(1)氯离子原子核外有
(2)溴在周期表中的位置
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是
②还原性按Cl-、Br-、I-的顺序依次增大,原因是
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是
(5)HClO有很好的杀菌消毒效果,为增强氯水的杀菌消毒能力,可用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因
更新时间:2019-10-27 13:08:15
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】海洋蕴藏着丰富的化学资源,氯、钠、镁、硫是海水中除了氢、氧以外含量最高的四种元素。
(1)氯、钠、镁、硫四种元素都处于周期表的第___________ 周期,其中原子半径最大的是___________ 。
(2)食盐的主要成分是氯化钠,写出该化合物的电子式___________ ,它是___________ 化合物(选填“离子”或“共价”)。
(3)硫元素的非金属性比氯元素___________ 。(选填“强”或“弱”)
(4)酸雨的成分很复杂,但主要以硫酸为主。写出检验某次降雨是否为酸雨的方法。___________
(5)NaHCO3俗称小苏打,可用于治疗胃酸过多,其原因是___________ 。
(1)氯、钠、镁、硫四种元素都处于周期表的第
(2)食盐的主要成分是氯化钠,写出该化合物的电子式
(3)硫元素的非金属性比氯元素
(4)酸雨的成分很复杂,但主要以硫酸为主。写出检验某次降雨是否为酸雨的方法。
(5)NaHCO3俗称小苏打,可用于治疗胃酸过多,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
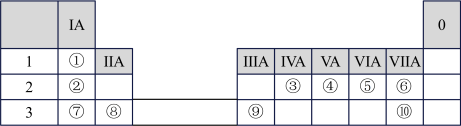
(1)自然界中,组成物质最多的元素在周期表中的位置是___________ 。上述元素中最高价氧化物对应的水化物碱性最强的是___________ (填化学式)。
(2)写出由①④⑩三种元素形成的一种盐的电子式___________ 。⑤⑦形成A2B2型化合物中所含的化学键类型为___________ 。
(3)⑥⑦⑨的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(4)根据对角线元素性质相似规则,写出②的最高价氧化物对应的水化物与稀硫酸反应的离子方程式:___________ 。
(5)①与④或⑤形成的两种10电子离子,在加热条件下能发生反应生成另两种10电子分子,写出对应的离子方程式:___________ 。
(6)⑥元素原子得电子能力强于⑩,请用原子结构知识解释其原因:___________ 。

(1)自然界中,组成物质最多的元素在周期表中的位置是
(2)写出由①④⑩三种元素形成的一种盐的电子式
(3)⑥⑦⑨的简单离子半径由大到小的顺序为
(4)根据对角线元素性质相似规则,写出②的最高价氧化物对应的水化物与稀硫酸反应的离子方程式:
(5)①与④或⑤形成的两种10电子离子,在加热条件下能发生反应生成另两种10电子分子,写出对应的离子方程式:
(6)⑥元素原子得电子能力强于⑩,请用原子结构知识解释其原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
(1)表中属于d区的元素是___________ (填元素符号),基态D原子最高能级的电子云轮廓图形状是___________ 。
(2)下列叙述正确的是___________ (填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA 离子的空间构型
离子的空间构型___________ ,ME2的电子式___________ ;M、D、E的第一电离能由大到小的顺序为___________ 。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素C与元素G的氢氧化物有相似的性质。请写出元素C的氢氧化物与NaOH溶液反应的化学方程式:___________ 。
(5)化合物甲是由E、F、H元素组成的一种正盐,化合物已是H的最高价氧化物对应水化物,丙溶液是H的氢化物的水溶液,当甲溶液与已稀溶液混合时,会产生一种无色有刺激性气味的气体。写出甲溶液、已溶液、丙溶液混合时所发生的的离子反应方程式___________ 。
| A | B | ||||||||||||||||
| C | M | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| N | J | ||||||||||||||||
| K | L |
(1)表中属于d区的元素是
(2)下列叙述正确的是
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA
 离子的空间构型
离子的空间构型(4)某些不同族元素的性质也有一定的相似性,如上表中元素C与元素G的氢氧化物有相似的性质。请写出元素C的氢氧化物与NaOH溶液反应的化学方程式:
(5)化合物甲是由E、F、H元素组成的一种正盐,化合物已是H的最高价氧化物对应水化物,丙溶液是H的氢化物的水溶液,当甲溶液与已稀溶液混合时,会产生一种无色有刺激性气味的气体。写出甲溶液、已溶液、丙溶液混合时所发生的的离子反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
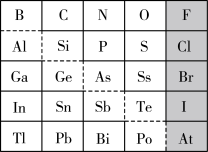
(1)Sn的最高正价为_______ ,I的最高价氧化物对应水化物的化学式为_______ ,Bi的最高价氧化物为_______ 。
(2)元素Ga在元素周期表中的位置为:_______ 。
(3)根据元素周期律等有关知识,推断:
①阴影部分元素的氢化物沸点最高的是_______ (填化学式)。
②N3-、O2-、Al3+、S2-,四种离子半径大小顺序:_______ (用离子符号排序)。
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:_______ 。
(4)查阅资料可知:硅酸(H2SiO3)是一种难溶于水的弱酸。为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用_______ 溶液,作用是_______ ,其中能说明C和Si非金属性强弱的化学方程式是:_______ 。
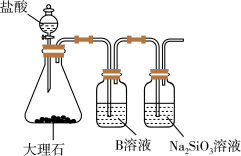

(1)Sn的最高正价为
(2)元素Ga在元素周期表中的位置为:
(3)根据元素周期律等有关知识,推断:
①阴影部分元素的氢化物沸点最高的是
②N3-、O2-、Al3+、S2-,四种离子半径大小顺序:
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:
(4)查阅资料可知:硅酸(H2SiO3)是一种难溶于水的弱酸。为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】有X、Y、Z三种短周期元素,已知X原子的L层电子比M层电子多2个; 的电子层结构与Ne的相同;Z与X处于同一周期,其气态单质呈黄绿色。回答下列问题:
的电子层结构与Ne的相同;Z与X处于同一周期,其气态单质呈黄绿色。回答下列问题:
(1)分别写出X、Y、Z元素的名称:_______ 、_______ 、_______ 。
(2)与Z同主族的元素中,氢化物的稳定性最强的是_______ (填化学式)。
(3)与Z元素同周期的元素,形成的含氧酸酸性最强的是_______ (填化学式)。
(4)写出Y单质与氢氧化钠溶液反应的化学方程式:_______ 。
(5)标准状况下,2.24L Z单质与足量氢氧化钙完全反应时,转移电子_______ mol。
(6)22.2g某二价金属与Z形成的化合物中含有0.4mol Z阴离子,则该金属的摩尔质量是_______ g/mol。
 的电子层结构与Ne的相同;Z与X处于同一周期,其气态单质呈黄绿色。回答下列问题:
的电子层结构与Ne的相同;Z与X处于同一周期,其气态单质呈黄绿色。回答下列问题:(1)分别写出X、Y、Z元素的名称:
(2)与Z同主族的元素中,氢化物的稳定性最强的是
(3)与Z元素同周期的元素,形成的含氧酸酸性最强的是
(4)写出Y单质与氢氧化钠溶液反应的化学方程式:
(5)标准状况下,2.24L Z单质与足量氢氧化钙完全反应时,转移电子
(6)22.2g某二价金属与Z形成的化合物中含有0.4mol Z阴离子,则该金属的摩尔质量是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铁及其化合物在生产、生活中存在广泛用途。

(1)如图是铁元素在元素周期表中的有关信息。
补全铁原子的核外电子排布式_____________ 3p63d64s2。“55.85”是________________________ 。自然界中存在的54Fe和56Fe,它们互称为_____________ 。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是_____________ 。通常证明某溶液中含Fe2+的化学方法是_____________________ 。
(3)SO2 有强还原性,写出其与 FeCl3 溶液反应的离子方程式______________________ 。
若有 0.4mol FeCl3 发生反应,则需要标准状况下的 SO2______________ 升。
(4)发黄的深井水通常含 Fe3+,若向水中加入 Na2CO3 溶液,则产生红褐色沉淀和无色无味的气体。请从平衡移动角度解释这一现象___________________ 。

(1)如图是铁元素在元素周期表中的有关信息。
补全铁原子的核外电子排布式
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是
(3)SO2 有强还原性,写出其与 FeCl3 溶液反应的离子方程式
若有 0.4mol FeCl3 发生反应,则需要标准状况下的 SO2
(4)发黄的深井水通常含 Fe3+,若向水中加入 Na2CO3 溶液,则产生红褐色沉淀和无色无味的气体。请从平衡移动角度解释这一现象
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是___ 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:___ 。
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___ ,其中氮元素原子最外层电子排布的轨道表示式是___ ,通过比较___ 可判断氮、磷两种元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是___ 。
(5)CS2熔点高于CO2,其原因是___ 。
 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
(4)已知CS2与CO2分子结构相似,CS2的电子式是
(5)CS2熔点高于CO2,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物。请回答下列问题:
⑴ A元素的名称是______ ,D在周期表中的位置 ______ ,E的离子结构示意图 ______ ;
⑵ B2分子的电子式:______ ,A2C的结构式:______ ;
⑶ 用电子式表示D2E化合物的形成过程为_____________________________ ;
⑷ 用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______________________ 。
⑴ A元素的名称是
⑵ B2分子的电子式:
⑶ 用电子式表示D2E化合物的形成过程为
⑷ 用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】硫、钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价层电子排布图为________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______ ,VO 的空间结构为
的空间结构为________ 。
 的空间结构为
的空间结构为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______ 。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ ;第三电离能的变化图是_______ (填标号)。
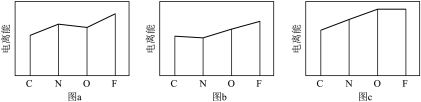
(1)基态F原子的价电子排布图(轨道表示式)为
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

您最近一年使用:0次



