N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g)  4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
下列说法中不正确的是
 4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A.500s内N2O5分解速率为2.96×10-3mol·L-1·s-1 |
| B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% |
| C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1 >T2,则K1>K2 |
D.平衡后,其他条件不变,将容器体积压缩到原来的 ,则c(NO2)<5.00mol·L-1 ,则c(NO2)<5.00mol·L-1 |
18-19高三·浙江·阶段练习 查看更多[2]
更新时间:2019-11-09 11:34:00
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】在一定条件下发生反应:A(g)+2B(g) 3C(g)+2D(s) △H=-219kJ•mol-1,在2L密闭容器中,把1molA和2molB混合,5min后达到化学平衡时生成1.5molC,则下列说法正确的是( )
3C(g)+2D(s) △H=-219kJ•mol-1,在2L密闭容器中,把1molA和2molB混合,5min后达到化学平衡时生成1.5molC,则下列说法正确的是( )
 3C(g)+2D(s) △H=-219kJ•mol-1,在2L密闭容器中,把1molA和2molB混合,5min后达到化学平衡时生成1.5molC,则下列说法正确的是( )
3C(g)+2D(s) △H=-219kJ•mol-1,在2L密闭容器中,把1molA和2molB混合,5min后达到化学平衡时生成1.5molC,则下列说法正确的是( )| A.用A计算的化学反应速率为0.25mol•L-1•min-1 |
| B.反应达平衡时气体B的体积分数占33.3% |
| C.升高体系的温度,正反应速率增大,逆反应速率减小,平衡将逆向移动 |
| D.压缩容器的体积使装置的压强增大,则平衡将逆向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】一定温度下,在
恒容 密闭容器中加入足量铁粉并充入一定量的 气体,发生反应
气体,发生反应 。下列说法
。下列说法不正确 的是

 气体,发生反应
气体,发生反应 。下列说法
。下列说法
A. 时, 时, 的平均反应速率为 的平均反应速率为 |
B.充入 ,容器内压强增大,则化学反应速率增大 ,容器内压强增大,则化学反应速率增大 |
C. 时, 时, ,反应未达到平衡状态 ,反应未达到平衡状态 |
D. 后,混合气体的平均分子量为35.1 后,混合气体的平均分子量为35.1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2 SO2(g)+ O2(g) 2SO3(g) △H<0。得到如表中的两组数据:
2SO3(g) △H<0。得到如表中的两组数据:
下列说法不正确的是
 2SO3(g) △H<0。得到如表中的两组数据:
2SO3(g) △H<0。得到如表中的两组数据:实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A.实验1在前6min的平均反应速率υ(SO2)=0.2 mol·L-1·min-1 |
| B.T1、T2的关系:T1 > T2 |
| C.K1、K2的关系:K2>K1 |
| D.x= 1.6,y=0.2 ,t<6 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】密闭恒温容器中进行下列反应:aA(g) bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
 bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )| A.化学计量数a>b |
| B.容器容积增大,平衡向逆反应方向移动 |
| C.容器容积增大,生成物B的质量分数增大 |
| D.该反应的正反应放出热量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g)  2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是A.该反应的化学平衡常数表达式是K=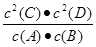 |
| B.该条件下B的平衡转化率是40% |
| C.增大该体系的压强,A的转化率增大 |
| D.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】SO2催化氧化是制硫酸的关键步骤:2SO2(g)+O2(g) 2SO3(g)。T1K时,在2L的恒温恒容容器中加入2mol SO2(g)和1mol O2(g),测得混合气体的总物质的量(mol)随时间的变化如表所示:
2SO3(g)。T1K时,在2L的恒温恒容容器中加入2mol SO2(g)和1mol O2(g),测得混合气体的总物质的量(mol)随时间的变化如表所示:
下列推断不正确 的是
 2SO3(g)。T1K时,在2L的恒温恒容容器中加入2mol SO2(g)和1mol O2(g),测得混合气体的总物质的量(mol)随时间的变化如表所示:
2SO3(g)。T1K时,在2L的恒温恒容容器中加入2mol SO2(g)和1mol O2(g),测得混合气体的总物质的量(mol)随时间的变化如表所示:| t/min | 0 | 3 | 6 | 10 | 15 | 25 | ∞ |
| n总/mol | 3 | 2.50 | 2.35 | 2.15 | 2.10 | 2.08 | 2.06 |
| A.0~15min,混合体系的压强逐渐减小 | B.0~10min,v(O2)=0.0425mol·L-1·min-1 |
| C.T1K时,SO2的平衡转化率为94% | D.T1K时,反应时间最好定为25min |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】一定温度下(T2>T1),在3个体积均为2.0 L的恒容密闭容器中反应 (正反应放热)达到平衡,下列说法正确的是
(正反应放热)达到平衡,下列说法正确的是
 (正反应放热)达到平衡,下列说法正确的是
(正反应放热)达到平衡,下列说法正确的是| 容器编号 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
| c(NO) | c(Cl2) | c(ClNO) | c(ClNO) | ||
| Ⅰ | T1 | 0.20 | 0.10 | 0 | 0.04 |
| Ⅱ | T1 | 0.20 | 0.10 | 0.20 | c1 |
| Ⅲ | T2 | 0 | 0 | 0.20 | c2 |
A.达到平衡时,容器Ⅱ中 比容器Ⅰ中的大 比容器Ⅰ中的大 |
| B.达到平衡时,容器Ⅲ中ClNO的转化率小于80% |
| C.达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为1:2 |
| D.若温度从T1变到T2,平衡常数K值增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:

下列说法正确的是
 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

下列说法正确的是
| A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min) |
| B.由图可知:T1<T2,且该反应为吸热反应 |
| C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动 |
| D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |
您最近一年使用:0次

 2Z(g)
2Z(g)

