(1)已知①H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
②CH4 (g)+ O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:___ 。
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=___ kJ·mol-1。
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。

回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为___ (保留两位有效数字)。
②X轴上a点的数值比b点__ (填“大”或“小”);图中,Y轴表示__ (填“温度”或“压强”),判断的理由是__ 。
 O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1②CH4 (g)+
 O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g)
 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为
②X轴上a点的数值比b点
更新时间:2019-11-26 09:23:50
|
相似题推荐
计算题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)实验测得,5 g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,甲醇的燃烧热ΔH=______________________ ;
(2)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式________________ 。
(3)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4 (g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:______________ 。
(2)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式
(3)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4 (g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)已知:H2(g)+ Cl2(g) ═ 2HCl(g) △H=-184.6 kJ•mol-1则反应HCl(g) ═1/2 H2(g) +1/2 Cl2(g)的△H为_______ 。
(2)由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是_______ kJ/mol。
(3)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为_______ kJ/mol
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为_________________________________ 。
(2)由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
(3)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】(1)已知:①CO(g)+ O2(g)=CO2(g)△H=-283.0kJ•mol-1
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______ 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H=______ 。
 O2(g)=CO2(g)△H=-283.0kJ•mol-1
O2(g)=CO2(g)△H=-283.0kJ•mol-1 ②CH3OH(l)+
 O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1 请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H=

您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐1】产生雾霾天气的原因之一是烟道气和汽车尾气(氮氧化物、NH3等)的排放,研究这些排放气的无害化处理是化学工作者研究的重要课题。
(1)已知1molN2(g)、1molO2(g)、1molN2O(g)分子中化学键断裂时分别需要吸收945kJ、498kJ、1112.5kJ的能量,请写出对N2O(g)进行无害化处理时的热化学方程式______ 。
(2)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)⇌2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是_____ (填字母代号)。
A.第一步对总反应速率起决定作用 B.第二步活化能比第三步大
C.N2O分解反应中,k(含碘)>k(无碘) D.I2浓度与N2O分解速率无关
(3)已知2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H=−744kJ/mol,为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10molCO和8molNO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。
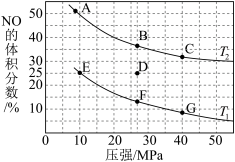
①该反应达平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施____ (填字母代号)。
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,请计算该温度下平衡常数Kp=_____ (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的______ 点。
(1)已知1molN2(g)、1molO2(g)、1molN2O(g)分子中化学键断裂时分别需要吸收945kJ、498kJ、1112.5kJ的能量,请写出对N2O(g)进行无害化处理时的热化学方程式
(2)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)⇌2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是
A.第一步对总反应速率起决定作用 B.第二步活化能比第三步大
C.N2O分解反应中,k(含碘)>k(无碘) D.I2浓度与N2O分解速率无关
(3)已知2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H=−744kJ/mol,为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10molCO和8molNO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。

①该反应达平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,请计算该温度下平衡常数Kp=
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐2】利用“萨巴蒂尔反应”[
 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。
已知:
试回答下列问题:
(1)①表示CO(g)燃烧热的热化学方程式:_______ 。
②C(s)燃烧仅生成CO(g)的热化学方程式:_______ ,当有6gC(s)完全燃烧时,放出_______ kJ热量。
(2)①若2mol由CO(g)、 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是_______ 。
②等质量的CO(g)、 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为_______ (用化学式表示)。
(3)每 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

_______  。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为_______ (填含a的代数式) 。
。

 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。已知:
| 物质 | CO(g) |  |  | C(s) |
燃烧热/( ) ) | 283 | 285.8 | 890.3 | 393 |
(1)①表示CO(g)燃烧热的热化学方程式:
②C(s)燃烧仅生成CO(g)的热化学方程式:
(2)①若2mol由CO(g)、
 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是②等质量的CO(g)、
 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为(3)每
 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

 。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为 。
。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】在恒温(500K)、体积为2.0L 的密闭容器中通入1.0 mol N2和1 mol H2发生合成氨反应,20 min 后达到平衡,测得反应放出的热量为 18.4 kJ,混合气体的总物质的量为 1.6 mol。
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率V(NH3)=__________ 。
(2)该反应的热化学方程式为_____________________________________________ 。
(3)若拆开1 mol H—H键和1 mol N N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________ kJ。
(4)判断该反应达到平衡状态的依据是____________ (填序号)。
①单位时间内消耗1mol N2 的同时消耗了3mol H2 ;
②单位时间内断裂1mol N≡N 的同时断裂了6mol N–H;
③V正(N2)=V逆(NH3);
④NH3的物质的量分数不再随时间而变化
⑤容器内气体的压强不再随时间而变化的状态 ;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2 ;
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率V(NH3)=
(2)该反应的热化学方程式为
(3)若拆开1 mol H—H键和1 mol N
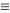 N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是(4)判断该反应达到平衡状态的依据是
①单位时间内消耗1mol N2 的同时消耗了3mol H2 ;
②单位时间内断裂1mol N≡N 的同时断裂了6mol N–H;
③V正(N2)=V逆(NH3);
④NH3的物质的量分数不再随时间而变化
⑤容器内气体的压强不再随时间而变化的状态 ;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2 ;
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐1】硫酸是重要化工原料之一,研究人员对其生产开展研究。请回答:
(1)工业上一般采用硫铁矿或硫黄粉为原料制备硫酸。
① ,
, 下,下列反应
下,下列反应


则反应 能自发进行的条件是
能自发进行的条件是_______ 。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)_______ 。
A.在制备 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在 转化为
转化为 阶段,控制温度在
阶段,控制温度在 左右的主要原因是为了提高反应速率和平衡转化率
左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: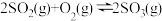
①不同温度下,具有一定能量的分子百分数与分子能量的关系如图所示,E表示 温度下分子的平均能量,
温度下分子的平均能量, 是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
_______  (填“>”、“=”或“<”)。若
(填“>”、“=”或“<”)。若 温度下使用催化剂,请在图中画出相应的变化:
温度下使用催化剂,请在图中画出相应的变化:_______ 。

②某温度下,假设进入接触室内 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少
的物质的量比为1∶1,反应达到平衡时压强减少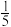 ;保持温度不变,欲使
;保持温度不变,欲使 的平衡转化率提高到90%,则开始时加入
的平衡转化率提高到90%,则开始时加入 和
和 的物质的量比为应为
的物质的量比为应为_______ (计算结果保留1位小数)。
③ 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:_______ 。
步骤Ⅲ:
(3) 的平衡转化率与反应温度和压强的关系如下图。
的平衡转化率与反应温度和压强的关系如下图。

①实际生产选择图中A点的反应条件,不选择B、C点的理由分别是_______ 。
②将组成(物质的量分数)为 和
和 的气体通入反应器,在温度t、压强p条件下进行反应:
的气体通入反应器,在温度t、压强p条件下进行反应: 。平衡时,若
。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)(用含 的代数式表示)。
的代数式表示)。
(1)工业上一般采用硫铁矿或硫黄粉为原料制备硫酸。
①
 ,
, 下,下列反应
下,下列反应

则反应
 能自发进行的条件是
能自发进行的条件是②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)
A.在制备
 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多B.两种方法产生的气体都不需要干燥
C.在
 转化为
转化为 阶段,控制温度在
阶段,控制温度在 左右的主要原因是为了提高反应速率和平衡转化率
左右的主要原因是为了提高反应速率和平衡转化率D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: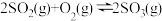
①不同温度下,具有一定能量的分子百分数与分子能量的关系如图所示,E表示
 温度下分子的平均能量,
温度下分子的平均能量, 是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
 (填“>”、“=”或“<”)。若
(填“>”、“=”或“<”)。若 温度下使用催化剂,请在图中画出相应的变化:
温度下使用催化剂,请在图中画出相应的变化:
②某温度下,假设进入接触室内
 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少
的物质的量比为1∶1,反应达到平衡时压强减少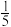 ;保持温度不变,欲使
;保持温度不变,欲使 的平衡转化率提高到90%,则开始时加入
的平衡转化率提高到90%,则开始时加入 和
和 的物质的量比为应为
的物质的量比为应为③
 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:步骤Ⅰ:

步骤Ⅱ:
步骤Ⅲ:

(3)
 的平衡转化率与反应温度和压强的关系如下图。
的平衡转化率与反应温度和压强的关系如下图。
①实际生产选择图中A点的反应条件,不选择B、C点的理由分别是
②将组成(物质的量分数)为
 和
和 的气体通入反应器,在温度t、压强p条件下进行反应:
的气体通入反应器,在温度t、压强p条件下进行反应: 。平衡时,若
。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐2】回答下列问题:
(1)已知25℃, 的
的 ,
, 的
的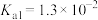 ,
,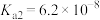 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的
_______  ,将
,将 通入该氨水中,当
通入该氨水中,当 降至
降至 时,溶液中的
时,溶液中的
_______ 。
(2) 可以被
可以被 溶液捕获。若所得溶液
溶液捕获。若所得溶液 ,
, 主要转化为
主要转化为_______ (写离子符号);若所得溶液 ,溶液
,溶液
_______ 。(室温下, 的
的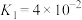 ;
; )
)
(3)在25℃下,将 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中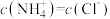 ,则溶液显性
,则溶液显性_______ (填“酸”、“碱”或“中”);用含a的代数式表示 的电离常数
的电离常数
_______ 。
(4)常温下,向一定体积的
 溶液中滴加等体积的
溶液中滴加等体积的 的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
_______ 。
(5)已知 ,若向
,若向
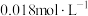 的
的 溶液中加入
溶液中加入
 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的 的浓度为
的浓度为_______  ,pH为
,pH为_______ 。
(1)已知25℃,
 的
的 ,
, 的
的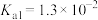 ,
,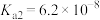 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的
 ,将
,将 通入该氨水中,当
通入该氨水中,当 降至
降至 时,溶液中的
时,溶液中的
(2)
 可以被
可以被 溶液捕获。若所得溶液
溶液捕获。若所得溶液 ,
, 主要转化为
主要转化为 ,溶液
,溶液
 的
的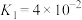 ;
; )
)(3)在25℃下,将
 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中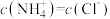 ,则溶液显性
,则溶液显性 的电离常数
的电离常数
(4)常温下,向一定体积的

 溶液中滴加等体积的
溶液中滴加等体积的 的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
(5)已知
 ,若向
,若向
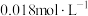 的
的 溶液中加入
溶液中加入
 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的 的浓度为
的浓度为 ,pH为
,pH为
您最近一年使用:0次

 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量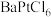 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
 的平衡常数K=
的平衡常数K=

