如图所示:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。
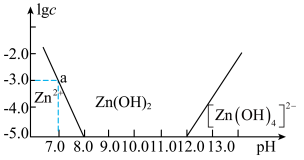
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为___ 。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=___ 。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是___ 。
(4)泡沫灭火器内装有NaHCO3饱和溶液;灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:___ (用离子方程式表示)。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3,阻止火势蔓延。其相关化学反应的离子方程式为:___ 。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是
(4)泡沫灭火器内装有NaHCO3饱和溶液;灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:
更新时间:2019-12-10 16:24:11
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】按要求完成下列问题。
(1)已知NaA水溶液呈碱性。
①NaA水溶液呈碱性的原因___________ (用离子方程式解释)。
②在NaA水溶液中各离子浓度的大小关系是___________ 。
(2)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的___________ (填写物质的名称)。把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填化学式)
(3)毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用重石制备BaCl2·2H2O的流程如图:

已知:
Ksp(BaC2O4)=1.6×10−7,Ksp(CaC2O4)=2.3×10−9。
加入NH3·H2O调pH=8可除去_____ (填离子符号),滤渣Ⅱ中含______ (填化学式)。加入H2C2O4时应避免过量,原因是_____ 。
(1)已知NaA水溶液呈碱性。
①NaA水溶液呈碱性的原因
②在NaA水溶液中各离子浓度的大小关系是
(2)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的
(3)毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用重石制备BaCl2·2H2O的流程如图:

已知:
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调pH=8可除去
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol/L)如图所示。
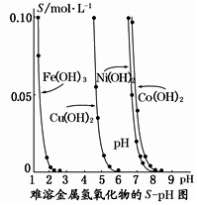
(1)当pH=3时,溶液中铜元素的主要存在形式是__________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH值为______ (填序号)。
A.<1 B.4左右 C.8>PH>6 D.>9
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_____________________________________________ 。
(4)已知一些难溶电解质的溶度积常数如右下表:
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________ (填序号)。
A.NaOH B.FeS C.Na2S D.NH4Cl

(1)当pH=3时,溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH值为
A.<1 B.4左右 C.8>PH>6 D.>9
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,
(4)已知一些难溶电解质的溶度积常数如右下表:
| 物质 | FeS | MnS | PbS | HgS | ZnS | CuS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 | 1.3×10-35 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S D.NH4Cl
您最近一年使用:0次
【推荐1】T1、T2两种温度下 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
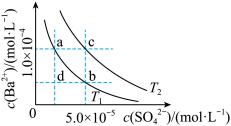
(1)T1___________ T2 (填“>”“<”或“=”),T2温度时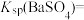
___________ 。
(2)根据T1温度时 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是___________ (填序号)。
A.加入 固体可由a点变为b点
固体可由a点变为b点
B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有 沉淀生成
沉淀生成
C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
(3) T2温度时,现有0.2mol的 沉淀,每次用1 L饱和
沉淀,每次用1 L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理___________ 次[提示: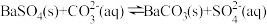
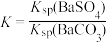 ,
,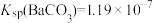 ]。
]。
 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
(1)T1
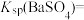
(2)根据T1温度时
 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是A.加入
 固体可由a点变为b点
固体可由a点变为b点B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有
 沉淀生成
沉淀生成C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
(3) T2温度时,现有0.2mol的
 沉淀,每次用1 L饱和
沉淀,每次用1 L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理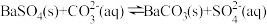
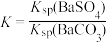 ,
,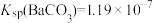 ]。
]。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】无色透明的锆石(主要成分为ZrSiO4)酷似钻石,是很好的钻石代用品。锆石又称锆英石,常含有铁、铝、铜的氧化物杂质。工业上一种以锆英石为原料制备ZrO2的工艺流程如图所示:
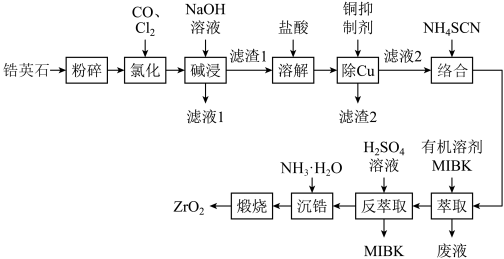
已知:i.Zr在化合物中通常显+4价,“氯化”过程中除C、O元素外,其他元素均转化为高价氯化物;
ii.SiCl4极易水解生成硅酸;ZrCl4易溶于水,390℃升华;
iii.Fe(SCN)3难溶于有机溶剂MIBK,Zr(SCN)4在水中的溶解度小于在有机溶剂MIBK中的溶解度。
常用的铜抑制剂有NaCN(氰化钠),NaCN可与铜离子反应生成Cu(CN)2{Ksp[Cu(CN)2]=4×10-10}沉淀。已知盐酸溶解后的溶液中Cu2+的浓度为1mol·L-1,当溶液中Cu2+浓度不大于1×10-6mol·L-1时即达到后续生产的要求,则欲处理1L该溶液至少需要2mol·L-1的NaCN溶液的体积为___________ L(溶液混合时的体积变化忽略不计,计算结果保留两位小数)。

已知:i.Zr在化合物中通常显+4价,“氯化”过程中除C、O元素外,其他元素均转化为高价氯化物;
ii.SiCl4极易水解生成硅酸;ZrCl4易溶于水,390℃升华;
iii.Fe(SCN)3难溶于有机溶剂MIBK,Zr(SCN)4在水中的溶解度小于在有机溶剂MIBK中的溶解度。
常用的铜抑制剂有NaCN(氰化钠),NaCN可与铜离子反应生成Cu(CN)2{Ksp[Cu(CN)2]=4×10-10}沉淀。已知盐酸溶解后的溶液中Cu2+的浓度为1mol·L-1,当溶液中Cu2+浓度不大于1×10-6mol·L-1时即达到后续生产的要求,则欲处理1L该溶液至少需要2mol·L-1的NaCN溶液的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol•L-1)如图所示。
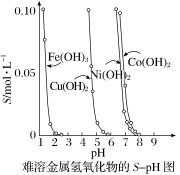
(1)pH=3时溶液中铜元素的主要存在形式是________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为_______ (填字母)。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_________ 。

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
您最近一年使用:0次

 固体的沉淀溶解平衡实验中,哪些现象能证明
固体的沉淀溶解平衡实验中,哪些现象能证明

