某反应中反应物与生成物有:NH3、H2SO4、KClO3、K2SO4、HNO3、H2O和一种未知物质X。
①已知KClO3在反应中得到电子,则该反应的还原剂是_____ 。
②已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为_____ 。
③根据上述反应可推知还原性:NH3_____ X (填>、<符号)。
①已知KClO3在反应中得到电子,则该反应的还原剂是
②已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为
③根据上述反应可推知还原性:NH3
更新时间:2020-01-23 01:36:10
|
相似题推荐
【推荐1】回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】氯气是重要的基本化工原料,广泛用于化学、冶金、造纸、纺织、医药、石油等工业,以及饮用水消毒、污水处理等方面。
(1)实验室制取Cl2的反应方程式为:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为
Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________ ;
(2)KMnO4和盐酸反应也可制取Cl2:
____ KMnO4+____ HCl=____ KCl+____ MnCl2+____ Cl2↑+____ H2O
请配平该反应方程式。当标准状况下有11.2L氯气生成时,该反应转移电子的数目为_____ 。
(3)用氯氧化法可处理含KCN的废水。液氯在碱性条件下可以将氰化物氧化成毒性仅为氰化物的千分之一的氰酸盐,氰酸盐再进一步被氧化为无毒物质。
①由反应KCN+2KOH+Cl2 = KOCN + 2KCl+H2O判断,氰酸盐KOCN中C元素的化合价为_________ (已知反应前后氮元素化合价未改变);
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:
2KOCN+4KOH+ 3Cl2 = 2CO2↑ + N2 ↑+6KCl + 2H2O
______________________________
③若某厂废水中含KCN的浓度为0.65g/L,处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯的物质的量为___________ mol。
(1)实验室制取Cl2的反应方程式为:4HCl(浓)+MnO2
 Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为
Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为(2)KMnO4和盐酸反应也可制取Cl2:
请配平该反应方程式。当标准状况下有11.2L氯气生成时,该反应转移电子的数目为
(3)用氯氧化法可处理含KCN的废水。液氯在碱性条件下可以将氰化物氧化成毒性仅为氰化物的千分之一的氰酸盐,氰酸盐再进一步被氧化为无毒物质。
①由反应KCN+2KOH+Cl2 = KOCN + 2KCl+H2O判断,氰酸盐KOCN中C元素的化合价为
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:
2KOCN+4KOH+ 3Cl2 = 2CO2↑ + N2 ↑+6KCl + 2H2O
③若某厂废水中含KCN的浓度为0.65g/L,处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯的物质的量为
您最近一年使用:0次
【推荐3】从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:MnO4-+ CuS + H+=Cu2+ + SO2↑ + Mn2++ H2O,请配平离子方程式并用单线桥法标出该反应中电子转移的方向和数目:___ 。
(2)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是__ ,氧化产物与还原产物的物质的量之比为___ 。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为__ L。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:MnO4-+ CuS + H+=Cu2+ + SO2↑ + Mn2++ H2O,请配平离子方程式并用单线桥法标出该反应中电子转移的方向和数目:
(2)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】在反应:8NH3+3Cl2==N2+6NH4Cl中,若共得到了28g氮气,试问:
(1)反应耗用的氧化剂的质量;_______________
(2)被氧化的还原剂的质量。_______________
(1)反应耗用的氧化剂的质量;
(2)被氧化的还原剂的质量。
您最近一年使用:0次
【推荐2】亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____ ___
___ ___=___
___=___ ___
___ ___
___ ___
___ ___
___ 。
。
(1)请完成该离子方程式并配平___________ 。
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.钠盐
(3)用上述反应来处理 开不是最佳方法,其原因是
开不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ 填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)
和NaCl的是___________(填序号)
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 车转化为
车转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列:
表现出的性质与下列:___________ (填序号)反应中 表现出的性质相同。
表现出的性质相同。
A.
B.
C.
(6) 可以与
可以与 反应制备
反应制备 纳米颗粒。若
纳米颗粒。若 与
与 的系数之比为1∶2,配平该反应的离子方程式:
的系数之比为1∶2,配平该反应的离子方程式:___________ 。
____ _____
_____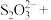 _____
_____ ____
____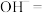 ____
____ ______
______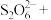 _____
_____
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____ ___
___ ___=___
___=___ ___
___ ___
___ ___
___ ___
___ 。
。(1)请完成该离子方程式并配平
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.钠盐
(3)用上述反应来处理
 开不是最佳方法,其原因是
开不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)
和NaCl的是___________(填序号)| A.分别溶于水,滴加酚酞试液 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 车转化为
车转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列:
表现出的性质与下列: 表现出的性质相同。
表现出的性质相同。A.

B.

C.

(6)
 可以与
可以与 反应制备
反应制备 纳米颗粒。若
纳米颗粒。若 与
与 的系数之比为1∶2,配平该反应的离子方程式:
的系数之比为1∶2,配平该反应的离子方程式:____
 _____
_____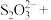 _____
_____ ____
____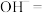 ____
____ ______
______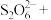 _____
_____
您最近一年使用:0次
【推荐3】请按要求完成下列各题:
(1)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,其中被还原的元素是___ ,被氧化的元素是___ 。
(2)配平以下方程式:___ K2Cr2O7+___ HCl═___ KCl+___ CrCl3+___ Cl2↑+___ H2O
(3)已知19.2gCu与过量的200ml5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).
3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的物质的量为___ mol;标准状况下,产生NO气体的体积为___ mL。
②反应后,NO3-的物质的量浓度为___ mol/L。
(1)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,其中被还原的元素是
(2)配平以下方程式:
(3)已知19.2gCu与过量的200ml5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).
3Cu+8HNO3
 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O①转移电子的物质的量为
②反应后,NO3-的物质的量浓度为
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
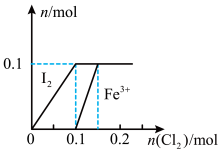
【推荐1】已知5Cl2+I2+6H2O=10HCl+2HIO3,HIO3不与Cl2继续反应。向200 mLFeI2溶液中缓慢通入Cl2,其中I2、Fe3+的物质的量随n(Cl2)的变化如图所示,请回答下列问题:______ 。
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为______ ,从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的离子方程式为______ 。
(3)在图中画出IO 的物质的量随n(Cl2)的变化曲线
的物质的量随n(Cl2)的变化曲线______ 。
(4)当溶液中n(Cl-):n(IO )=8:1时,通入的氯气在标准状况下的体积为
)=8:1时,通入的氯气在标准状况下的体积为______ 。
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为
(3)在图中画出IO
 的物质的量随n(Cl2)的变化曲线
的物质的量随n(Cl2)的变化曲线(4)当溶液中n(Cl-):n(IO
 )=8:1时,通入的氯气在标准状况下的体积为
)=8:1时,通入的氯气在标准状况下的体积为
您最近一年使用:0次
【推荐2】现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。请回答下列问题:

(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为__ ,还原产物是__ 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式__ 。
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:__ 。
②n(KBrO3)=4时,对应含碘物质的化学式为__ 。
(4)含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为__ 。

(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:
②n(KBrO3)=4时,对应含碘物质的化学式为
(4)含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐3】将含有铜的印刷线路板浸入200 mL氯化铁浓溶液中,有19.2 g铜被腐蚀掉。取出印刷线路板,向溶液中加入16.8 g铁粉,经充分反应,溶液中还存在9.6 g不溶物(设溶液体积不变)。回答下列问题:
(1)写出铜与氯化铁溶液反应的离子方程式_______ 。
(2)充分反应后,溶液中存在的9.6 g不溶物的成分为_______ 。
(3)充分反应后溶液中一定不存在的金属离子为_______ 。
(4)Fe2+、Fe3+、Cu2+的氧化性由强到弱的顺序为_______ ,最后所得溶液中Fe2+的物质的量浓度为_______ mol·L-1。
(1)写出铜与氯化铁溶液反应的离子方程式
(2)充分反应后,溶液中存在的9.6 g不溶物的成分为
(3)充分反应后溶液中一定不存在的金属离子为
(4)Fe2+、Fe3+、Cu2+的氧化性由强到弱的顺序为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4+4C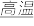 Na2S+4CO
Na2S+4CO
② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1) 现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)__________ g;
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量范围n的范围是________ < n <________ ;
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=_______ ;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为______ mol;Na2SO3的物质的量为_______ mol;Na2SO4的物质的量为_________ mol。
① Na2SO4+4C
 Na2S+4CO
Na2S+4CO② Na2SO4+4CO
 Na2S+4CO2
Na2S+4CO2(1) 现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量范围n的范围是
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】在反应:8NH3+3Cl2==N2+6NH4Cl中,若共得到了28g氮气,试问:
(1)反应耗用的氧化剂的质量;_______________
(2)被氧化的还原剂的质量。_______________
(1)反应耗用的氧化剂的质量;
(2)被氧化的还原剂的质量。
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】金属锡的纯度可以通过下述方法测定:将样品溶于盐酸Sn+2HCl=SnCl2+H2↑,再加过量的FeCl3溶液。发生如下反应:SnCl2+2FeCl3=SnCl4+2FeCl2,最后可用一定浓度的K2Cr2O7溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有金属锡试样0.613g,经上述反应后,共用去0.1mol/L的K2Cr2O7的硫酸溶液16.0mL。
⑴ 写出K2Cr2O7氧化Fe2+的离子方程式,并配平__________________ ;
⑵ 试样中锡的质量分数(假定杂质不参加反应)__________________ 。
⑴ 写出K2Cr2O7氧化Fe2+的离子方程式,并配平
⑵ 试样中锡的质量分数(假定杂质不参加反应)
您最近一年使用:0次



