为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+ O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+ O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________ 。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________ 。
(3)相关物质的化学键键能数据如下:
计算x=________ kJ·mol-1。
(4)某反应2X(g)+Y(g)⇌2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
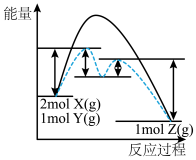
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。
已知:① CO(g)+
 O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1② H2(g)+
 O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:
(3)相关物质的化学键键能数据如下:
| 化学键 | O=O(O2) | H—H | H—O |
| E/(kJ·mol-1) | x | 436 | 463 |
计算x=
(4)某反应2X(g)+Y(g)⇌2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。

①加入催化剂M后,△H
②在使用催化剂的两部反应中,
更新时间:2020-02-19 12:24:26
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。___________ 。
(2)反应A的热化学方程式是___________ (注意:不写条件)。
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为___________ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)___________ 。
(4)请回答:
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:___________ 。
(5)已知甲烷的燃烧热为890.3kJ·mol-1,H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=___________ 。
(6)二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:
①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
=-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
=+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:___________ 。
反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.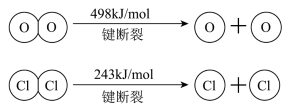
(2)反应A的热化学方程式是
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为
(4)请回答:
| 参加反应的物质及状态 |  |  | 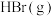 |
| 1mol分子中的化学键断裂时需要吸收的能量 | 436 | a | 369 |
(5)已知甲烷的燃烧热为890.3kJ·mol-1,H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=
(6)二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:
①2H2(g)+O2(g)=2H2O(g)
 = -483.6 kJ·mol-1
= -483.6 kJ·mol-1②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)
 =-1366.8kJ·mol-1
=-1366.8kJ·mol-1③H2O(l)=H2O(g)
 =+44.0kJ·mol-1
=+44.0kJ·mol-1则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________ (填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________ 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l) O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)
O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g) N2(g)+2H2O(l)的ΔH=
N2(g)+2H2O(l)的ΔH=____ kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为________
(4)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)
 O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)
O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g) N2(g)+2H2O(l)的ΔH=
N2(g)+2H2O(l)的ΔH=(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为
(4)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
您最近一年使用:0次
【推荐3】乙醛(CH3CHO)是有机合成中的二碳试剂,是合成乙酸、乙醇、乙酸乙酯、农药DDT等的原料。回答下列问题:
(1)Andrea Dasic 等提出在金属催化剂M作用下以N2O为氧化剂可以氧化乙烯生成乙醛。催化体系氧化还原循环如图所示。(物质与氧原子的结合力用OA表示)
氧原子与N生成NO的结合力OA(N)= 167.4kJ·mol-1,氧原子与乙烯生成乙醛的结合力OA(C2 H4)=473 kJ∙mol-1,则可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足:_______ ,使用催化剂会使该反应的活化能____ (填“增大”或“减小”)。
(2)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ∙mol-1、890.31 kJ· mol-1、1167.9 kJ∙mol-1,则乙醛的分解反应CH3CHO(l) CH4(g)+CO(g)的 ∆H =
CH4(g)+CO(g)的 ∆H =________ 。
(3)已知:在含有少量I2的溶液中,反应CH3CHO(aq) CH4 (g)+CO(g)分两步进行:
CH4 (g)+CO(g)分两步进行:
第I步反应为CH3CHO(aq) +I2(aq)→CH3I(l) + HI(aq) +CO(g)(慢反应),第II步为快反应。
①请写出第II步反应的化学方程式:__________ 。
②增大I2的浓度______ (填“能"或“不能")明显增大总反应的平均速率,理由为_________ 。
(4)乙醛可以与饱和的NaHSO3溶液发生反应生成水溶性的 -羟基磺酸钠:CH3CHO+ NaHSO3
-羟基磺酸钠:CH3CHO+ NaHSO3 CH3CH(OH)SO3Na(
CH3CH(OH)SO3Na( -羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将
-羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将___ (填“ 正向”“逆向”或“不")移动。
(5)在100~120 °C、PdCl2 – CuCl2催化剂存在下,乙烯可以与O2反应生成乙醛: 2CH2=CH2(g) +O2(g) 2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为
2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为____ (结果保留3位有效数字),T °C时该反应的平衡常数K为________ 。
(1)Andrea Dasic 等提出在金属催化剂M作用下以N2O为氧化剂可以氧化乙烯生成乙醛。催化体系氧化还原循环如图所示。(物质与氧原子的结合力用OA表示)
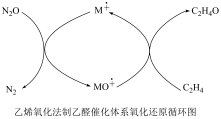
氧原子与N生成NO的结合力OA(N)= 167.4kJ·mol-1,氧原子与乙烯生成乙醛的结合力OA(C2 H4)=473 kJ∙mol-1,则可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足:
(2)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ∙mol-1、890.31 kJ· mol-1、1167.9 kJ∙mol-1,则乙醛的分解反应CH3CHO(l)
 CH4(g)+CO(g)的 ∆H =
CH4(g)+CO(g)的 ∆H =(3)已知:在含有少量I2的溶液中,反应CH3CHO(aq)
 CH4 (g)+CO(g)分两步进行:
CH4 (g)+CO(g)分两步进行:第I步反应为CH3CHO(aq) +I2(aq)→CH3I(l) + HI(aq) +CO(g)(慢反应),第II步为快反应。
①请写出第II步反应的化学方程式:
②增大I2的浓度
(4)乙醛可以与饱和的NaHSO3溶液发生反应生成水溶性的
 -羟基磺酸钠:CH3CHO+ NaHSO3
-羟基磺酸钠:CH3CHO+ NaHSO3 CH3CH(OH)SO3Na(
CH3CH(OH)SO3Na( -羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将
-羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将(5)在100~120 °C、PdCl2 – CuCl2催化剂存在下,乙烯可以与O2反应生成乙醛: 2CH2=CH2(g) +O2(g)
 2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为
2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________ 。
(2)N2O4与NO2转化的热化学方程式为N2O4(g) 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________ (填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________ (填“变深”“变浅”或“不变”),判断理由______________________________________ 。
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________ (用p总、各气体物质的量分数x表示);影响K的因素为________ 。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________ (填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________ 。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________ 。
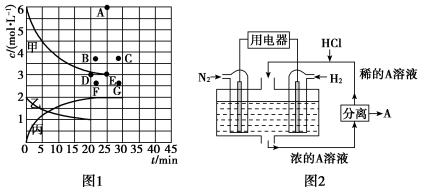
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________ ,A是_______________________________ 。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
| 化学键 | N—H | N—N | N≡N | O—H |
| 键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2转化的热化学方程式为N2O4(g)
 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是

(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是
您最近一年使用:0次
【推荐2】甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。
相关化学键的键能数据
方法I:二氧化碳催化加氢制甲醇
在一定温度下,利用催化剂将CO2和H2合成CH3OH.已知各反应物、产物均为气体。回答下列问题:
(1)写出CO2和H2反应生成CH3OH和水的热化学方程式:___________ 。
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。
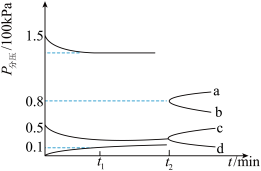
若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为 ,
,
①此时用H2压强表示0-t1时间内的反应速率v(H2)=___________ kPa·min-1若再向该容器中充入1molCO2和3molH2,平衡将___________ (填正向,逆向或不)移动。
②t2时将容器体积迅速压缩为原来的一半,图中能正确表示压缩体积后CO2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由___________ 。
若其它条件不变,T1°C时测得平衡体系的压强为plkPa;T2°C时,测得平衡体系的压强为p2kPa,若p1>p2,则T1___________ T2(填“>”、“<”或“无法确定)。
③在该温度下,反应的标准平衡常数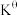 =
=___________ 。(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)=gG(g)+hH(g),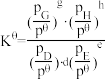 ,其中
,其中 =100kPa,pG,pH,pD,pE,为组分平衡分压)
=100kPa,pG,pH,pD,pE,为组分平衡分压)
方法II:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示。
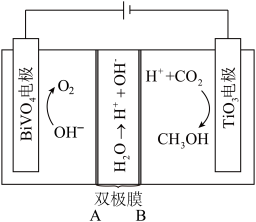
(3)双极膜B侧为___________ (填“阴离子”或“阳离子”交换膜。
(4)TiO2电极上电极反应方程式:___________ 。
相关化学键的键能数据
| 化学键 | C=O | H-H | C-H | C-O | H-O |
| 键能E/(kJ·mol-1) | 806 | 436 | 413 | 343 | 465 |
在一定温度下,利用催化剂将CO2和H2合成CH3OH.已知各反应物、产物均为气体。回答下列问题:
(1)写出CO2和H2反应生成CH3OH和水的热化学方程式:
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。

若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为
 ,
,①此时用H2压强表示0-t1时间内的反应速率v(H2)=
②t2时将容器体积迅速压缩为原来的一半,图中能正确表示压缩体积后CO2分压变化趋势的曲线是
若其它条件不变,T1°C时测得平衡体系的压强为plkPa;T2°C时,测得平衡体系的压强为p2kPa,若p1>p2,则T1
③在该温度下,反应的标准平衡常数
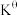 =
=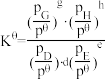 ,其中
,其中 =100kPa,pG,pH,pD,pE,为组分平衡分压)
=100kPa,pG,pH,pD,pE,为组分平衡分压)方法II:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示。

(3)双极膜B侧为
(4)TiO2电极上电极反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
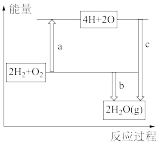
(1)已知破坏1 mol H—H、1 mol O=O、1 mol H—O时分别需要吸收436 kJ、498 kJ、465 kJ的能量。下图表示H2、O2转化为水反应过程的能量变化,则b表示的能量为_______ 。
(2)氢氧燃料电池是用于驱动电动汽车的理想能源。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为:_______ 。
②电池工作时 K+ 向_______ 移动(填“正极”或“负极”)。
③电池工作一段时间后电解质溶液的pH_______ (填“增大”“减小”或“不变”)。
(3)CO2可通过反应 转化成有机物,实现碳循环。一定条件下,在体积为2L恒容密闭容器中,充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L恒容密闭容器中,充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
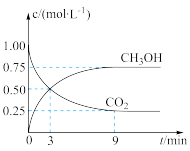
①下列可以表明该反应达到化学平衡状态的是_______ 。
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.CH3OH的浓度不再改变
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率_______ 逆反应速率(填“>”、“<”或“=”)。
③从0min到9min内,v(H2)=_______ mol/(L·min)。
④平衡时混合气体中CH3OH(g)的体积分数是_______ 。
(1)已知破坏1 mol H—H、1 mol O=O、1 mol H—O时分别需要吸收436 kJ、498 kJ、465 kJ的能量。下图表示H2、O2转化为水反应过程的能量变化,则b表示的能量为

(2)氢氧燃料电池是用于驱动电动汽车的理想能源。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为:
②电池工作时 K+ 向
③电池工作一段时间后电解质溶液的pH
(3)CO2可通过反应
 转化成有机物,实现碳循环。一定条件下,在体积为2L恒容密闭容器中,充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L恒容密闭容器中,充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①下列可以表明该反应达到化学平衡状态的是
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.CH3OH的浓度不再改变
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率
③从0min到9min内,v(H2)=
④平衡时混合气体中CH3OH(g)的体积分数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2催化加氢制甲醇的反应器中存在如下反应:
i.CO2(g) +3H2(g)=CH3OH(g)+H2O(g) △H1<0
ii.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3<0
(1) 5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
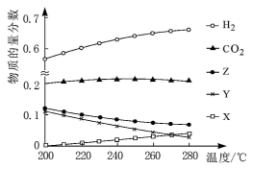
①体系中CO2的物质的量分数受温度的影响不大,原因是__ 。
②曲线__ (填“X”、“Y”或“Z”)代表CH3OH。
(2) 利用△H1计算甲醇摩尔燃烧热时,还需要利用反应___ 的△H。
(3) 反应i可能的反应历程如图所示。

①反应历程中,生成甲醇的决速步骤的反应方程式为___ 。
②△H1=___ (计算结果保留1位小数)。(已知:leV=1.6×10-22kJ)
注:方框内包含微粒种类及数目、微粒的相对总能量(如最后一个方框表示1个CH3OH(g)分子+1个H2O(g)分子的相对总能量为-0.51eV,单位:eV。)其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
(4) 750K下,在恒容密闭容器中,仅发生反应CH3OH(g) CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=
CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=___ (用含P0和a的式子表示)。
i.CO2(g) +3H2(g)=CH3OH(g)+H2O(g) △H1<0
ii.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3<0
(1) 5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①体系中CO2的物质的量分数受温度的影响不大,原因是
②曲线
(2) 利用△H1计算甲醇摩尔燃烧热时,还需要利用反应
(3) 反应i可能的反应历程如图所示。

①反应历程中,生成甲醇的决速步骤的反应方程式为
②△H1=
注:方框内包含微粒种类及数目、微粒的相对总能量(如最后一个方框表示1个CH3OH(g)分子+1个H2O(g)分子的相对总能量为-0.51eV,单位:eV。)其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
(4) 750K下,在恒容密闭容器中,仅发生反应CH3OH(g)
 CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=
CO(g)+2H2(g),若起始时充入CH3OH(g),压强为P0,达到平衡时转化率为a,则平衡时的总压强P平=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国科学家开发新型高效催化剂,在太阳能作用下制备双氧水。
I.双氧水不稳定。
(1)实验研究发现,碘离子催化双氧水分解反应分两步进行,其反应历程如图所示。
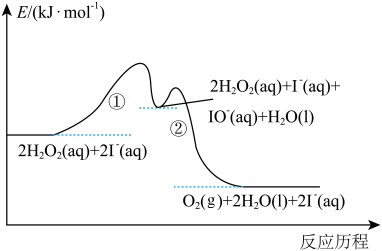
①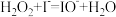 ;
;
②_______ (补充离子方程式)。其中,反应_______ 控制总反应速率(填“①”或“②”)。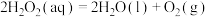

_______ 0(填“>”“<”或“=”)。
(2)双氧水在碘离子催化下发生分解反应: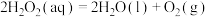 ,其速率方程为
,其速率方程为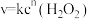 (k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
(k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
常温下,该反应的速率常数
_______ (不写单位)。
II.查阅资料知: 是一种弱酸,298K时
是一种弱酸,298K时 的
的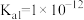 ,
,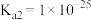 。
。
(3)298K时,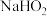 溶液中
溶液中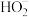 的水解常数为
的水解常数为_______ 。
III.测定双氧水溶液的浓度。
(4)已知:酸性条件下,双氧水和高锰酸钾反应, 生成,写出反应的离子方程式:
生成,写出反应的离子方程式:_______ 。
(5)取 mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
 标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
_______ mol·L (用含c、V、
(用含c、V、 的代数式表示)。若滴定管用蒸馏水洗涤后没有用
的代数式表示)。若滴定管用蒸馏水洗涤后没有用 标准溶液润洗,则测得的结果
标准溶液润洗,则测得的结果_______ (填“偏高”“偏低”或“无影响”)。
I.双氧水不稳定。
(1)实验研究发现,碘离子催化双氧水分解反应分两步进行,其反应历程如图所示。

①
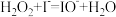 ;
;②
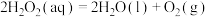

(2)双氧水在碘离子催化下发生分解反应:
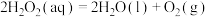 ,其速率方程为
,其速率方程为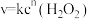 (k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
(k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。| 序号 | 反应时间/min |  /(mol·L /(mol·L ) ) | v/(mol·L ·min ·min ) ) |
| ① | 0 | 0.80 | 0 |
| ② | 20 | 0.40 | 0.020 |
| ③ | 40 | 0.20 | 0.010 |
| ④ | 60 | 0.10 | 0.005 |
| ⑤ | 80 | 0.05 | 0.0025 |

II.查阅资料知:
 是一种弱酸,298K时
是一种弱酸,298K时 的
的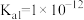 ,
,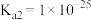 。
。(3)298K时,
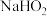 溶液中
溶液中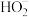 的水解常数为
的水解常数为III.测定双氧水溶液的浓度。
(4)已知:酸性条件下,双氧水和高锰酸钾反应,
 生成,写出反应的离子方程式:
生成,写出反应的离子方程式:(5)取
 mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
 标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
 (用含c、V、
(用含c、V、 的代数式表示)。若滴定管用蒸馏水洗涤后没有用
的代数式表示)。若滴定管用蒸馏水洗涤后没有用 标准溶液润洗,则测得的结果
标准溶液润洗,则测得的结果
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】上饶市正在创建“全国文明城市”,对碳的化合物做广泛深入的研究并妥善处理具有重要意义。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中______ (填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCH
C. •OCH2 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2O
II.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正______ v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=______ Pa2。
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:______ 。
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为______ 。
(5)每转移0.2mol电子,阳极室溶液质量减少______ g。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为
A.•OCH3
 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCHC. •OCH2
 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2OII.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为
(5)每转移0.2mol电子,阳极室溶液质量减少
您最近一年使用:0次



