铅是一种金属元素,可用作耐酸腐蚀、蓄电池等的材料。其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有_______ 种能量不同的电子,其次外层的电子云有_______ 种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是______ (填化学式),气态氢化物沸点最低的是_____________ (填化学式)。
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
__ PbO2+___ MnSO4+___ HNO3 →___ HMnO4+___ Pb(NO3)2+___ PbSO4↓+____ ____
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为_______ 个。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
更新时间:2020-03-22 15:51:03
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】从核心元素价态分析,亚硝酸盐(如NaNO2)、亚铁盐(如FeSO4)都应既具有氧化性,又具有还原性。亚硝酸盐对应的酸为亚硝酸(HNO2),HNO2是一种弱酸,且不稳定,易分解生成NO和NO2。
(1)HNO2中N原子为_______ 价,其酸酐(对应的酸性氧化物)为_______ (写化学式)。
(2)请用“双线桥”表示NaNO2与HI反应时电子的转移情况_______ 。
2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(3)NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。关于该过程的叙述不正确的是_______(填字母)。
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______ 。
(5)FeSO4可用于制备一种新型、高效、多功能绿色水处理剂——高铁酸钾(K2FeO4)。制备原理为
①2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
②Na2FeO4+2KOH=2K2FeO4+2NaOH
K2FeO4氧化性比Cl2、O2、ClO2、KMnO4更强,还原产物为Fe3+。反应①中氧化剂为_______ (写化学式),还原剂为_______ (写化学式);简要说明K2FeO4作为水处理剂时所起的作用_______ (写出两点)。
(6)以下能从FeSO4水溶液中置换出Fe的金属为_______ 。
a.钾 b.钙 c.钠 d.锌
(1)HNO2中N原子为
(2)请用“双线桥”表示NaNO2与HI反应时电子的转移情况
2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(3)NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。关于该过程的叙述不正确的是_______(填字母)。
| A.亚硝酸盐的氧化性强于Fe3+ |
| B.维生素C是还原剂 |
| C.维生素C的还原性强于Fe2+ |
| D.亚硝酸盐是还原剂 |
(5)FeSO4可用于制备一种新型、高效、多功能绿色水处理剂——高铁酸钾(K2FeO4)。制备原理为
①2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
②Na2FeO4+2KOH=2K2FeO4+2NaOH
K2FeO4氧化性比Cl2、O2、ClO2、KMnO4更强,还原产物为Fe3+。反应①中氧化剂为
(6)以下能从FeSO4水溶液中置换出Fe的金属为
a.钾 b.钙 c.钠 d.锌
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】实验室制取氯气的反应原理为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
(1)该反应中氧化剂是___________ (填化学式)。若反应中生成1分子Cl2,则转移的电子数为___________ 个。当生成71gCl2时,被氧化的物质的质量为 ___________ g。
(2)写出该反应的离子方程式:___________ 。
(3)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,用单线桥法表示电子转移的方向和数目:
MnCl2+Cl2↑+2H2O,用单线桥法表示电子转移的方向和数目:___________ 。
(4)有一种“地康法”制取氯气的反应原理如下所示:
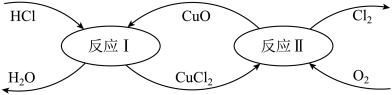
①反应Ⅰ的离子方程式为___________ 。
②“地康法”制取氯气的总反应方程式为:___________ 。
③工业生产中常用NH3检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:___________ 。
(5)实验室迅速制备少量氯气也可利用如下反应:2KMnO4 + 16HCl(浓)=2MnCl2 +2KCl +5Cl2↑ + 8H2O,此反应常温下就可以迅速进行,根据上述反应确定MnO2、Cl2、KMnO4的氧化性由强到弱的顺序为___________ 。
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:(1)该反应中氧化剂是
(2)写出该反应的离子方程式:
(3)MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,用单线桥法表示电子转移的方向和数目:
MnCl2+Cl2↑+2H2O,用单线桥法表示电子转移的方向和数目:(4)有一种“地康法”制取氯气的反应原理如下所示:

①反应Ⅰ的离子方程式为
②“地康法”制取氯气的总反应方程式为:
③工业生产中常用NH3检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:
(5)实验室迅速制备少量氯气也可利用如下反应:2KMnO4 + 16HCl(浓)=2MnCl2 +2KCl +5Cl2↑ + 8H2O,此反应常温下就可以迅速进行,根据上述反应确定MnO2、Cl2、KMnO4的氧化性由强到弱的顺序为
您最近一年使用:0次
填空题
|
适中
(0.64)
【推荐3】高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是__________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:________________________ 。
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为_________ g。需要的玻璃仪器有 ____________________________
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是:__________________________ 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为____________ 。并用单线桥表示电子的转移情况 ______________ 。
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是:
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】1987年诺贝尔物理学奖颁发给发现了临界转变温度为35K的镧钡铜氧超导体的两位科学家。镧(La)是一种活动性比锌强的金属,其氧化物为La2O3,对应的碱难溶于水,而镧的盐酸盐LaCl3与硝酸盐La(NO3)3均易溶于水。完成下列填空:
(1)氢氧化镧的化学式为_______ ,其中正离子是_______ (填微粒符号)。
(2)写出下列转化的化学方程式:
①La→LaCl3:_______ 。
②La2O3→La(NO3)3:_______ 。
(1)氢氧化镧的化学式为
(2)写出下列转化的化学方程式:
①La→LaCl3:
②La2O3→La(NO3)3:
您最近一年使用:0次
【推荐2】回答下列问题
(1)高铁酸钠( )是一种新型净水剂。制取高铁酸钠所发生的反应如下:
)是一种新型净水剂。制取高铁酸钠所发生的反应如下:
_______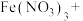 _______NaOH+_______
_______NaOH+_______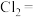 _______
_______ _______
_______ _______NaCl+_______
_______NaCl+_______
①配平上述反应方程式_______ 。
②该反应中 是
是_______ (填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
(2)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
② 可将废水中的
可将废水中的 转化为
转化为 而除去,本身还原为
而除去,本身还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。
(3)能将KI氧化为 的氧化剂有
的氧化剂有 、
、 、
、 、
、 、
、 、
、 等。已知下列四种氧化剂氧化KI后对应的还原产物如下:
等。已知下列四种氧化剂氧化KI后对应的还原产物如下:
①请判断等物质的量的四种氧化剂分别与足量KI作用,得到 最多的是
最多的是_______ 。
②根据信息“氧化性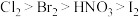 ”,对于含
”,对于含 、
、 的某混合溶液,若控制氧化
的某混合溶液,若控制氧化 而不氧化
而不氧化 ,请提出一种合理的氧化方案:向该混合溶液中加入
,请提出一种合理的氧化方案:向该混合溶液中加入_______ 。
(4)水合肼( )是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[
)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[ ]反应制得粗肼(
]反应制得粗肼(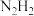 )。生成粗肼反应的化学方程式为:
)。生成粗肼反应的化学方程式为: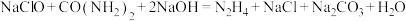 ,请用双线桥法表示该反应电子转移的方向和数目
,请用双线桥法表示该反应电子转移的方向和数目_______ 。
(1)高铁酸钠(
 )是一种新型净水剂。制取高铁酸钠所发生的反应如下:
)是一种新型净水剂。制取高铁酸钠所发生的反应如下:_______
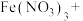 _______NaOH+_______
_______NaOH+_______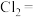 _______
_______ _______
_______ _______NaCl+_______
_______NaCl+_______
①配平上述反应方程式
②该反应中
 是
是(2)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 转化为
转化为 而除去,本身还原为
而除去,本身还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为(3)能将KI氧化为
 的氧化剂有
的氧化剂有 、
、 、
、 、
、 、
、 、
、 等。已知下列四种氧化剂氧化KI后对应的还原产物如下:
等。已知下列四种氧化剂氧化KI后对应的还原产物如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  | NO |
 最多的是
最多的是②根据信息“氧化性
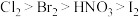 ”,对于含
”,对于含 、
、 的某混合溶液,若控制氧化
的某混合溶液,若控制氧化 而不氧化
而不氧化 ,请提出一种合理的氧化方案:向该混合溶液中加入
,请提出一种合理的氧化方案:向该混合溶液中加入(4)水合肼(
 )是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[
)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[ ]反应制得粗肼(
]反应制得粗肼(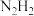 )。生成粗肼反应的化学方程式为:
)。生成粗肼反应的化学方程式为: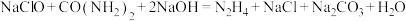 ,请用双线桥法表示该反应电子转移的方向和数目
,请用双线桥法表示该反应电子转移的方向和数目
您最近一年使用:0次
【推荐3】Cu2S与一定浓度的HNO3反应,反应除了生成Cu(NO3)2、CuSO4和水以外,还有可能生成NO2或NO。回答下列问题:
(1)当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为___ 。
(2)若反应按上题发生,则被氧化的元素是____ 。
(3)若反应的还原产物只有NO2,且生成的物质的量为5mol,则电子转移的物质的量为__________ 。
(4)当反应的还原产物既有NO又有NO2时,Cu2S与HNO3反应的物质的量有多种系数比,原因是___ 。
(1)当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
(2)若反应按上题发生,则被氧化的元素是
(3)若反应的还原产物只有NO2,且生成的物质的量为5mol,则电子转移的物质的量为
(4)当反应的还原产物既有NO又有NO2时,Cu2S与HNO3反应的物质的量有多种系数比,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)上述所有元素的最高价氧化物对应水化物中,碱性最强的水化物是_______ (用化学式表示,下同)。
(2)b、c、d的简单离子半径由大到小的顺序为_______ 。
(3)b、f、g的简单氢化物中,稳定性最弱的是_______ 。
(4)设计由NaCl、AlCl3的混合溶液制取Al2O3固体的实验方案:_______ 。(实验中可以选用的试剂是盐酸、氨水和NaOH溶液)
(5)j是元素周期表中第32号元素。
①j在周期表中的位置是_______ 。
②j及其化合物的性质正确的是_______ (填字母)。
A.j的单质常温下为气体
B.j的单质可用于制半导体
C.j的单质可能具有强氧化性
D.j的最高价氧化物对应水化物的酸性比H3PO4弱

(1)上述所有元素的最高价氧化物对应水化物中,碱性最强的水化物是
(2)b、c、d的简单离子半径由大到小的顺序为
(3)b、f、g的简单氢化物中,稳定性最弱的是
(4)设计由NaCl、AlCl3的混合溶液制取Al2O3固体的实验方案:
(5)j是元素周期表中第32号元素。
①j在周期表中的位置是
②j及其化合物的性质正确的是
A.j的单质常温下为气体
B.j的单质可用于制半导体
C.j的单质可能具有强氧化性
D.j的最高价氧化物对应水化物的酸性比H3PO4弱
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝酸、硫酸和盐酸,“两碱”是指烧碱和纯碱。回答下列问题:
(1)请写出硝酸中的氮元素在元素周期表中的位置___________ 。
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列___________ 。
(3)氯的非金属性比硫_______ (填“强”或“弱”),请用一个事实说明你的结论________ 。
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:①________ ;②Na2CO3;③_________ ;④NaHCO3。若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是_________ g。
(1)请写出硝酸中的氮元素在元素周期表中的位置
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列
(3)氯的非金属性比硫
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:①
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是_________ 。根据对角线规则,B的一些化学性质与元素________ 的相似。
(2)氨硼烷在催化剂作用下水解释放氢气: ,
, 的结构
的结构 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由________ 变为________ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ- ),电负性大小顺序是________ 。
(1)H、B、N中,原子半径最大的是
(2)氨硼烷在催化剂作用下水解释放氢气:
 ,
, 的结构
的结构 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ- ),电负性大小顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)生成物A的电子式为:__________________ ,属于______________ 晶体。
(2)黑火药中位于短周期的元素有_________ 种。其中有一种元素的单质可制药,其氧化物可做防腐剂,该元素在周期表中的位置是_________ ,该元素的原子核外有_______ 种不同运动状态的电子。
(3)黑火药所含元素中原子半径从大到小的顺序是______________ (用元素符号表示);
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有___________________ 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
2KNO3+3C+S
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)(1)生成物A的电子式为:
(2)黑火药中位于短周期的元素有
(3)黑火药所含元素中原子半径从大到小的顺序是
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】铁元素和碳元素形成的单质及化合物在生产、生活中有广泛的用途,
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为_________________ ;其最外层电子的电子云形状为___________ 。
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为____________________ 。
写出一种与NH4+互为等电子体的分子的电子式:________________________________ 。
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为______________ 。CO的沸点高于N2的原因是_________________________ 。
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为______________________ 。
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为________________ ;1cm3晶体的平均质量为___________ (列出计算式即可)。
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为
写出一种与NH4+互为等电子体的分子的电子式:
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】如图是s能级和p能级的原子轨道图,试回答下列问题:
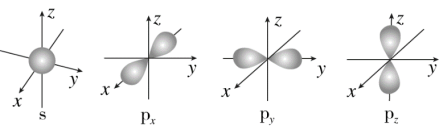
(1)s电子的原子轨道呈_______ 形,每个s能级有_______ 个原子轨道;p电子的原子轨道呈_______ 形,每个p能级有_______ 个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是_______ 电子,其电子云在空间有_______ 方向。
(3)下列原子或离子的电子排布式或轨道表示式正确的是_______ (填序号)
①K+: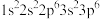
②F: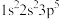
③P: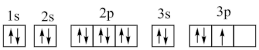
④Cu: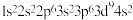
⑤Fe2+: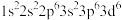
⑥Mg:
⑦O: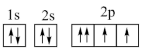

(1)s电子的原子轨道呈
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是
(3)下列原子或离子的电子排布式或轨道表示式正确的是
①K+:
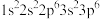
②F:
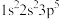
③P:
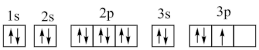
④Cu:
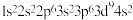
⑤Fe2+:
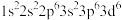
⑥Mg:

⑦O:
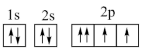
您最近一年使用:0次



